
|
|
无机化学。 备忘单:简而言之,最重要的
目录
1. 体内新陈代谢过程与能量的关系。 热力系统 地球上的生命过程很大程度上是由于太阳能在生物物质(蛋白质、脂肪、碳水化合物)中的积累,以及随后这些物质在生物体内的转化以及能量的释放。 A. M. Lavoisier (1743-1794) 和 P. S. Laplace (1749-1827) 的作品通过直接量热测量表明,生命中释放的能量是由动物吸入的空气中的氧气对食品的氧化作用决定的。 随着 XIX-XX 世纪的发展。 热力学,可以定量计算生化反应中的能量转换并预测其方向。 热力学方法基于许多严格的概念:“系统”、“系统状态”、“系统内能”、“系统状态函数”。 热力系统 任何自然物体都被称为,由足够多的分子(结构单元)组成,并通过真实或虚构的边界表面(界面)与其他自然物体分开。 不包括在系统中的自然物体称为环境。 系统最常见的特征是 m - 系统中所含物质的质量,以及 E - 系统的内能。 系统物质的质量由构成它的分子的总质量决定。 体系的内能是分子热运动的能量和它们之间相互作用的能量之和。 系统按与环境进行物质和能量交换的性质分为隔离型、封闭型和开放型三种。 孤立的系统 称为不与介质交换物质或能量的系统(Δm = 0,ΔE = 0)。 封闭系统是这样的系统,它不与环境交换物质,但可以交换能量(Δm = 0,ΔE^0)。 能量的交换可以通过传热或做功来进行。 开放系统 这样的系统被称为可以与介质进行物质和能量交换的系统(Δm≠0,ΔE≠0)。 开放系统的一个重要例子是活细胞。 系统,根据组成它们的物质的聚集状态,分为均质和异质。 在均质系统中,从系统的一个区域移动到另一个区域时,物理和化学性质没有急剧变化。 这种系统的一个例子是血浆,它是各种生物物质的溶液。 异构系统由两个或多个同构部分组成。 异质系统的一个例子是全血,即含有细胞(红细胞和白细胞)的血浆。 2. 热力学第一定律。 表征系统的概念 热力学第一定律为分析各种系统的能量提供了严格的定量框架。 为了制定它,有必要引入一些表征系统的新概念。 最重要的概念之一是系统的状态。 状态被理解为一组系统属性,可以从热力学的角度定义系统。 作为系统状态的广义特征,使用了以下概念:“平衡”、“静止”、“过渡状态”。 如果所有属性在任何很长一段时间内保持不变并且系统中没有物质和能量流动,则系统的状态称为平衡。 如果系统的性质在时间上是恒定的,但存在物质和能量的流动,则该状态称为静止状态。 定量地,状态在热力学变量的帮助下被区分。 热力学变量是表征整个系统状态的那些量。 它们也称为系统的热力学参数。 最重要的热力学变量是压力 p、温度 T、系统体积 V 或系统总质量 m、构成系统的化学物质(成分)质量 mk,或这些物质的浓度 m。 应该注意的是,医生使用类似的特征(温度、体重、生物体液的成分、血压)来确定患者的状况。 系统从一种状态到另一种状态的转变称为 按过程. 作为该过程的结果,系统的状态和热力学变量会发生变化。 如果我们将初始状态下的热力学变量的值表示为 X1 ,最后 - X2 , 那么这个变量的变化分别等于 ΔX = X2 -X1 并且称为热力学变量 X 的增量。该增量用相反的符号表示,称为变量 X 的减少。 系统 E 的内能是热力学状态函数之一。 状态函数的一个重要特征是它们独立于实现系统给定状态的方法。 系统内能的变化ΔE是由于系统与环境相互作用过程中所做的功W以及环境与系统之间的热交换Q,这些量之间的比值为热力学第一定律的内容。 系统在某个过程中增加的内能ΔE等于系统接收到的热量Q加上该过程对系统所做的功W: ΔE=Q+W。 在生物系统中,热量通常由系统散发到外部环境,由于内部能量的损失由系统做功。 用以下形式表示热力学第一定律的数学记录很方便: ΔE = Q - W。 上述公式中的所有量均以焦耳 (J) 为单位。 3. 热力学第一定律 热力学第一定律是自然界的基本定律之一,不能从任何其他定律推导出来。 大量实验证明了它的有效性,特别是建造第一类永动机的失败尝试,即这种机器可以在不从外部提供能量的情况下做任意长时间的工作。 根据系统中过程的条件,使用从热力学第一定律推导出来的各种状态函数。 同时,不使用复杂的生物系统,而是使用简化模型来获得关于质量和能量转换的结论。 系统中的压力保持恒定,它等于外部压力。 在 p = const 时发生的此类过程称为等压过程。 已知等压过程中所做的膨胀功为: W = ρΔV, 其中 ΔV 是系统的体积增量,等于状态 2 和状态 1 中的体积之差。 将展开式的工作代入第一定律的数学表达式并进行简单变换,我们得到: Qρ = ΔE + pΔV = (E2 + ρV2)-(E1 +ρΔV1) 其中 Qρ 是等压过程的热量; 1, 2 - 与进程开始和结束相关的索引。 值 (E + pV) 是系统状态的函数,用 H 表示,称为焓: H = E + ρV。 因此,表达式可以写成: Qp = H2 - H1 = ΔH。 从这个表达式可以得出 焓 - 状态函数,其增量等于等压过程中系统接收的热量。 某过程中焓增量的测量可以通过在量热计中在恒压下进行该过程来进行。 这就是 A. M. Lavoisier 和 P. S. Laplace 进行实验的方式,研究生物体内新陈代谢的能量。 如果系统状态的变化以恒定的体积发生,则该过程称为等容。 在这种情况下,体积变化 AV 等于 0,根据公式,膨胀功 W = XNUMX。然后由热力学第一定律的数学表达式得出: Qv = ΔE。 热力学定义由上述关系得出: 内能 - 状态函数,其增量等于系统在等容过程中获得的热量QV。 因此,可以通过在量热计中以恒定体积进行该过程来测量某个过程中内能的变化。 因此,在 ρ = const 时,内能和焓的增量由以下关系相关: ΔH = ΔE + ρΔV。 4.赫斯定律 研究化学反应中能量转换的热力学部分称为化学热力学。 表示与该反应对应的内能变化ΔE、焓ΔH或其他状态函数的反应方程称为热化学反应方程。 系统焓减小(ΔH<0)并将热量释放到外部环境中的化学反应称为 放热的. 焓增加 (ΔH > 0) 和系统吸收热量 Q 的反应p 外面叫 吸热的. 葡萄糖被氧气氧化,释放大量热量(Qp \u2800d XNUMX kJ / / mol),即这个过程是放热的。 相应的热化学方程式可写为 С6 Н12 О6 + 602 = 6С02 +6Н2哦,ΔH = 2800 kJ。 溶液中发生的反应通常伴随着体系体积的微小变化,即 ΔV ≈ 0。在这方面,在许多情况下,在生物学计算中,我们可以假设 ΔH = ΔE。 因此,此类系统中的热量释放主要是由于反应导致内能降低,反之亦然。 化合物 A 的生成焓是系统焓的变化 ΔHA 伴随着由单一物质形成 1 mol 的化合物 A。 假设氧、碳、氢和所有其他元素(简单)物质的形成焓为零。 在其他条件相同的情况下,内能和焓与系统中物质的数量成正比。 这样的热力学函数被称为广泛的。 从热力学的角度来看,一般形式n的反应AA + pВ = nС + nD , Δh 是系统从初始状态的转变与焓 H1 用焓 H 表示状态 22. 由于这种转变而导致的系统焓变化,称为该反应的焓,等于差: ΔH皮亚 = H2 - H1 =(没有cHc + nDHD) - (nАНА + nBHB). 热和恒定定律是1840年俄罗斯化学家G.I.赫斯发现的。他是热力学第一定律在化学转化中的适用性的发现者和化学热力学的奠基人。 目前,赫斯定律被认为是热力学第一定律的结果,其公式如下:在恒定压力下由给定试剂形成给定产物的焓增量不取决于导致形成的反应的数量和类型这些产品。 在热化学计算中,更经常使用的不是赫斯定律本身,而是它的结果,上面针对等式形式的葡萄糖氧化的特定情况推导出来 (2)。 对于以一般形式 p 表示的反应АA + pвB = = nсC + nDD,赫斯定律的一个结果是用等式 ΔH 写成的皮亚 =(没有CΔHC + nDΔHD) - (nAΔHA ++nBΔHB ),公式如下: 反应焓等于化学计量的产物的生成焓的代数和减去化学计量的反应物的生成焓的代数和。 5. 热力学第二定律。 吉布斯自由能 身体通过消耗以其组成物质的原子的化学相互作用的能量形式存储的内部能量来做功。 热力学第一定律的数学表达式 ΔE \uXNUMXd Q - W 确定了系统消耗的内能 ΔЕ、系统所做的功 W 和能量 Q 之间的确切关系,能量 Q 以热。 然而,根据热力学第一定律,不可能确定消耗的内能中可以转化为功的部分。 理论成本估算基于热力学第二定律。 该法律对将能量转化为功的效率施加了严格的限制,此外,还允许您为过程自发流动的可能性引入标准。 该过程称为 自发的如果它是在没有任何影响的情况下进行的,则当系统自行处理时。 存在系统内能不变的过程(ΔE = 0)。 这样的过程包括,例如,乙酸在水中的离子化。 许多自发过程随着内能的增加而进行(ΔE > 0)。 这尤其包括白蛋白(血浆蛋白)与金属离子(例如 Cu)形成生物无机化合物的典型反应2+. 封闭系统的内能 AE 变化不能作为自发过程的标准。 因此,由此推导出该标准的热力学第一定律不足以解决自发性问题以及过程的效率问题。 借助热力学第二定律可以解决这些问题。 为了制定热力学第二定律,有必要引入热力学意义上的可逆和不可逆过程的概念。 如果系统处于平衡状态,则在相同的外部条件下,这种状态将无限期地保持。 当外部条件发生变化时,系统的状态会发生变化,即系统中会发生一个过程。 如果在从初始状态 1 到最终状态 2 的转变过程中,所有中间状态都处于平衡状态,则称该过程是热力学可逆的。 如果至少有一个中间状态是非平衡状态,则该过程称为热力学不可逆过程。 可逆过程只有在系统参数(温度、压力、物质浓度等)变化足够慢的情况下才能进行。参数的变化率应使过程中出现的平衡偏差可以忽略不计。 应该指出的是,医学中的一个重要问题与可逆性有关——组织在低温下的保存。 可逆过程是自然界中发生并在工业或实验室中进行的真实过程的极限情况。 6. 热力学第二定律。 熵 最大功Wмакс,在从状态 1 到状态 2 的转变过程中,可以通过给定的内部能量损失 ΔE 获得,只有当这个过程是可逆的时才能实现。 根据热力学第一定律的表达式,最小热 Q分 Q分 \uXNUMXd ΔE - Wмакс . 表征系统内能成本效率的最大可实现效率因子分别等于 ηмакс=Wмакс /ΔE。 在从状态 1 到状态 2 的不可逆转换过程中,系统所做的功小于 W。 计算最大因子 hмакс 在已知 ΔE 值的情况下,有必要知道 W 的值макс 或问分 Wмакс = ΔE - Q分 , 因此, ηмакс \u1d XNUMX - ΔE / Q分 . Q值分 可以使用称为熵的热力学状态函数从热力学第二定律计算。 熵的概念是由德国物理学家 R. Yu. Clausius (1865-1822) 引入的(1888 年),他是热力学和热过程的分子动力学理论的创始人之一。 根据克劳修斯的熵的热力学定义:熵是一个状态函数,其增量 ΔS 等于热 Q分 在可逆等温过程中带入系统,除以执行该过程的绝对温度 T: ∆S = Q分 /T。 由公式可知,熵的单位为 J/K。 可逆等温过程的一个例子是冰在装满 273°K 水的热水瓶中缓慢融化。 已经通过实验确定,要融化 1 摩尔冰(18 克),至少需要提供 6000 焦耳的热量。 在这种情况下,热水瓶中“冰-水”系统的熵增加了ΔS = 6000 J:273°K = 22 J/K。 将装有水的保温瓶冷却到 273°K 时,可以缓慢带走 6000J 的热量,水结晶过程中会形成 1mol 的冰。 对于这个过程,Q分 式中为负。 相应地,1摩尔冰形成过程中“冰-水”系统的熵减少ΔS = 22 J/K。 类似地,如果在这些过程中提供给系统或从中移除的热量是已知的,则可以计算任何等温物理和化学过程的熵变化。 正如物理学所知,这种热量可以使用量热测量来确定。 因此,熵的变化,以及系统状态的其他两个函数——内能和焓,是一个实验确定的量。 当从分子动力学的角度考虑孤立系统中发生的过程时,熵以及内能的物理意义就清楚地揭示出来了。 7. 玻尔兹曼公式 根据定义,孤立系统不与环境交换物质或能量。 当然,这样的系统在自然界中并不真正存在。 然而,通过将系统放置在用软木塞密封的热水瓶中,可以获得非常好的绝缘效果。 事实证明,任何自发过程只有在以熵增加为特征的孤立系统中才能发生。 在平衡状态下,系统的熵是常数: ΔS ≥ 0。 该陈述基于实验观察,是热力学第二定律的可能公式之一。 根据热力学第二定律,与自发相反的过程不能在孤立系统中进行,因为这种过程的特征是熵减少。 对各种孤立系统的检查表明,自发过程总是与系统微状态 w 数量的增加有关。 在同样的过程中,系统的熵 S 增加,即熵随着微观状态数的增加而增加。 奥地利物理学家 L. Boltzmann 第一次注意到这种依赖的存在,他在 1872 年提出了这种关系: КБ =R/NA = 1,38 - 1023 J/K, 其中 KБ - 玻尔兹曼常数,等于气体常数 R 与阿伏伽德罗常数 N 的比值A . 这种关系称为玻尔兹曼公式。 玻尔兹曼公式使得从理论上计算系统可能的微状态数的熵成为可能。 这样的计算与实验确定的值非常吻合。 特别是,已知晶体物质在 0°K 时的微观状态数接近 w0 “1. 因此,可以确定结晶物质的熵的绝对值,而内能 E 和焓 H 只能确定相对值。 在许多情况下,系统微观状态数量的增加可能与该系统中无序的增加有关,并与系统能量的更可能分布的转变有关。 基于玻尔兹曼关系,可以给出熵的分子动力学定义。 熵是系统处于给定状态的概率的量度或系统无序的量度。 熵概念的重要性在于,基于该值可以预测自发过程的方向。 然而,根据热力学第二定律的公式,测量熵作为过程方向标准的适用性仅限于孤立系统。 8. 吉布斯能量 一种新的状态函数,吉布斯能量,被引入作为开放和封闭系统中过程自发性的标准。 这个函数是以伟大的美国物理学家 DW Gibbs (1839-1903) 的名字命名的,他推导了这个函数,然后将其用于热力学工作。 吉布斯能量是根据焓 H 和熵 S 使用以下关系确定的: G = H - S, ΔG = ΔH - ΔS。 基于吉布斯能量,热力学第二定律可以表述如下: 在等压等温条件下(p,T=const),只有这样的过程才能在系统中自发发生,结果系统的吉布斯能量减小(ΔG < 0)。在平衡状态下,吉布斯能量为系统不会改变(G = const,AG = 0)。 ΔG < 0, p, T = 常数。 综上所述,吉布斯能量在生物能过程的研究中起着重要作用。 使用此状态函数,您可以预测生物系统中自发过程的方向并计算可实现的最大效率。 吉布斯能量 G 与焓 H 一样,是系统状态的函数。 因此,吉布斯能量的变化 ΔG 可用于以与焓变化 ΔH 类似的方式来表征化学转化。 表示与这些反应相对应的吉布斯能量变化的反应方程也称为热化学反应方程。 化学反应,在此期间系统的吉布斯能量减少(ΔG < 0)并且做功,称为放能。 反应,其结果是吉布斯能量增加(ΔG > 0)并在系统上完成工作,称为 endergonic。 吉布斯能量源自热力学第二定律,是状态的函数。 因此,就像焓一样,吉布斯能量的赫斯定律可以表述为以下形式: 在恒定压力和温度下由给定试剂形成给定产物期间吉布斯能量的变化不取决于导致这些产物形成的反应的数量和类型。 应用赫斯定律的一个重要例子是计算葡萄糖氧化与分子氧反应的吉布斯能量。 在体外测定的 p = 101 kPa 和 T = 298°K 时,该反应中吉布斯能量的变化为 ΔG° = 2880 kJ/mol。 相应的热化学方程式写为: С6Н12О6 + 6O2 = 6CO2 +6Н2哦,ΔG皮亚° = 2880 千焦/摩尔。 在身体的细胞中,这种反应是通过生物化学家研究的多个连续阶段进行的。 从赫斯定律可以预测,所有中间反应的吉布斯能量变化之和为ΔG皮亚: ΔG1 +ΔG2 +ΔG3 + … + ∆Gn = ∆G皮亚 °。 反应的吉布斯能量等于化学计量产物的吉布斯形成能的代数和减去化学计量的反应物的吉布斯形成能的代数和: ΔG皮亚 =(没有cΔGc + nDΔGD)(nAΔGA + nBΔGB). 9. 解决方案。 解决方案分类 根据聚集状态,溶液可以是气态、液态和固态。 任何溶液都由溶质和溶剂组成,尽管这些概念有些武断。 例如,根据酒精和水的量比,该系统可以是酒精在水中的溶液或水在酒精中的溶液。 通常,溶剂被认为是与溶解前处于相同聚集状态的溶液中的组分。 溶液学说对医生特别感兴趣,因为最重要的生物体液——血液、淋巴液、尿液、唾液、汗液——是盐、蛋白质、碳水化合物、脂质在水中的溶液。 生物体液参与营养物质(脂肪、氨基酸、氧气)、药物向器官和组织的运输,以及代谢物(尿素、胆红素、二氧化碳等)从体内的排泄。 血浆是细胞(淋巴细胞、红细胞、血小板)的介质。 在身体的液体介质中,酸度、盐分和有机物质的浓度保持不变。 这种恒定性称为浓度稳态。 解决方案分类 摩尔质量小于5000 g/mol的物质溶液称为低分子化合物溶液(NMS),摩尔质量大于5000 g/mol的物质溶液称为高分子化合物溶液(管理中心)。 根据是否存在电解解离,NMS 溶液分为两类——电解质溶液和非电解质溶液。 电解质溶液 - 盐、酸、碱、两性电解质解离成离子的溶液。 例如,KNO 解决方案3, 盐酸, 氢氧化钾, 铝 (OH)3 ,甘氨酸。 电解质溶液的电导率高于溶剂。 非电解质溶液 - 实际上不会在水中解离的物质溶液。 例如,蔗糖、葡萄糖、尿素的溶液。 非电解质溶液的电导率与溶剂的电导率差别不大。 NMS(电解质和非电解质)溶液被称为真溶液,与胶体溶液相反。 真溶液的特点是成分均匀,溶质和溶剂之间没有界面。 溶解颗粒(离子和分子)的大小小于 109米 大多数宫内节育器是聚合物,其分子(大分子)由大量通过化学键相互连接的重复基团或单体单元组成。 宫内节育器溶液称为聚电解质溶液。 聚电解质包括聚酸(肝素、聚腺苷酸、聚天冬氨酸等)、聚碱(聚赖氨酸)、聚两性电解质(蛋白质、核酸)。 HMS 解决方案的属性与 NMS 解决方案的属性有很大不同。 因此,它们将在单独的部分中讨论。 本章专门讨论低分子量电解质、两性电解质和非电解质的溶液。 10. 水作溶剂 我们星球上最常见的溶剂是水。 一个平均体重 70 公斤的人的身体含有大约 40 公斤的水。 同时,大约有25公斤的水落在细胞内的液体上,其中15公斤是细胞外液,包括血浆、细胞间液、脑脊液、眼内液和胃肠道的液体内容物。 在动植物生物体中,水分通常在50%以上,在某些情况下水分含量达到90-95%。 由于其异常性质,水是一种独特的溶剂,非常适合生命。 首先,水能很好地溶解离子和许多极性化合物。 水的这种特性主要是由于其高介电常数(78,5)。 另一大类高度溶于水的物质包括极性有机化合物,如糖、醛、酮和醇。 它们在水中的溶解度可以通过水分子与这些物质的极性官能团形成极性键的趋势来解释,例如与醇和糖的羟基或与醛和酮的羰基的氧原子形成极性键。 以下是对生物系统中物质的溶解度很重要的氢键的例子。 由于其高极性,水会导致物质水解。 由于水是人体内部环境的主要组成部分,它提供了人体吸收、移动营养物质和代谢产物的过程。 应该注意的是,水是物质(尤其是葡萄糖)生物氧化的最终产物。 由于这些过程,水的形成伴随着大量能量的释放——大约 29 kJ / mol。 水的其他异常性质也很重要:高表面张力、低粘度、高熔点和沸点,以及液态比固态更高的密度。 水的特征在于存在缔合物 - 由氢键连接的分子组。 根据它们对水的亲和力,溶解颗粒的官能团分为亲水性(吸引水)、易被水溶剂化、疏水性(排斥水)和两亲性。 亲水基团包括极性官能团:羟基-OH、氨基-NH2 ,硫醇-SH,羧基-COOH。 对于疏水-非极性基团,例如烃基:CHXNUMX-(CH2)п -, 从6Н5 -. 氨基酸包括分子中同时含有两个亲水基团(-OH、-NH2 , -SH, -COOH) 和疏水基团:(CH3 - (CH2)п ,-从6Н5-)。 当两亲性物质溶解时,由于与疏水基团的相互作用,水的结构发生了变化。 靠近疏水基团的水分子的有序度增加,水分子与疏水基团的接触最小化。 疏水基团缔合,将水分子推出其所在区域。 11.溶液的浓度及表示方法 解 两种或多种物质处于平衡状态的可变成分的均质系统称为均质系统。 构成溶液的物质称为溶液成分。 溶液的一个重要特征是它的浓度。 该值决定了解决方案的许多属性。 物质浓度 (溶液成分)是通过一定质量或体积的溶液或溶剂中所含溶质的量来测量的量。 最常用的浓度表示方式有:质量分数、摩尔浓度、摩尔当量浓度、摩尔分数、体积分数、效价。 质量分数 W(倍) 以单位的分数、百分比 (%)、ppm(千分之一)和百万分率 (ppm) 表示。 质量分数由以下公式计算: W(倍) =米(倍)/米(PP), W(倍) =米(倍)/米(PP)×100%, 其中米(倍) - 给定组分 X(溶质)的质量,kg (g); m(PP) 是溶液的质量,kg (g)。 摩尔浓度以 mol/m 表示3 , 摩尔/分米3 , 摩尔/厘米3 , 摩尔/升, 摩尔/毫升。 在医学上,最好使用 mol/l 单位。 摩尔浓度由下式计算: C(倍) =n(X)/V(页) =米(倍)/M(倍) ×V(右), 其中 n(X) - 系统溶解物质的量,mol; M(倍) 是溶质的摩尔质量,kg/mol或g/mol; m(倍) 是溶解物质的质量,分别为 kg 或 g; V(右) - 溶液体积,升。 摩尔浓度 b(倍) 以 mol/kg 为单位表示。 记录形式,例如:b(HCl)\u0,1d XNUMX mol/kg。 通过公式计算摩尔浓度: b(倍) =n(X)/m(rl) =米(倍)/M(倍) × 米(rl) 其中米(rl) - 溶剂质量,kg。 在化学中,当量和等价因子的概念被广泛使用。 相等的 称为物质 X 的真实或条件粒子,它在给定的酸碱反应中相当于一个氢离子,或在给定的氧化还原反应中 - 一个电子,或在给定的盐之间的交换反应中 - 一个单位收费。 体积分数 f(X) 以单位的分数或百分比表示,计算公式如下: Ф(X) V =(倍)/ V(右) 其中v(倍) - 溶液中该组分 X 的体积; V(右) 是溶剂的总体积。 溶液的滴度用 T 表示(X), 计量单位 - 公斤/厘米3 , 克/厘米3 , 克/毫升。 可以使用以下公式计算溶液的滴度: Т(X) =米(倍)/ V(右) 其中米(倍) 是物质的质量,通常是 g; V(右) 溶液体积,毫升。 12. 解散过程 溶解过程的性质是复杂的。 自然地,问题就出现了,为什么有些物质易溶于某些溶剂而难溶或几乎不溶于另一些溶剂。 溶液的形成总是与某些物理过程有关。 一种这样的过程是溶质和溶剂的扩散。 由于扩散,颗粒(分子、离子)从溶解物质的表面去除,并均匀分布在溶剂的整个体积中。 这就是为什么在没有搅拌的情况下,溶解速度取决于扩散速度。 但是,仅仅通过物理过程是无法解释物质在各种溶剂中溶解度不均的。 伟大的俄罗斯化学家 D. I. Mendeleev (1834-1907) 认为化学过程在溶解中起着重要作用。 他证明了硫酸水合物的存在 H2所以4H2哦2所以42H2哦2所以44H2O 和其他一些物质,例如 C2Н5OH3H2A. 在这些情况下,溶解伴随着溶质颗粒和溶剂之间化学键的形成。 这个过程称为溶剂化,在特定情况下,当溶剂是水时,称为水合。 正如所确定的那样,根据溶质的性质,溶剂化物(水合物)可以作为物理相互作用的结果形成:离子-偶极相互作用(例如,当溶解具有离子结构的物质(NaCl 等)时;偶极-偶极相互作用 - 当溶解具有分子结构的物质时(有机物质))。 由于供体-受体键而进行化学相互作用。 这里,溶质离子是电子受体,溶剂(Н2哦,新罕布什尔州3) - 电子供体(例如,水络合物的形成),以及氢键形成的结果(例如,酒精在水中的溶解)。 溶质与溶剂发生化学相互作用的证据由热效应和伴随溶解的颜色变化提供。 例如,当氢氧化钾溶解在水中时,会释放热量: 氢氧化钾 + xN2O \uXNUMXd KOH (N2哦; ΔH°解决方案 = 55 焦耳/摩尔。 当氯化钠溶解时,会吸收热量: 氯化钠 + xH2O = NaCl(H2哦; ΔH°解决方案 = +3,8 千焦/摩尔。 当 1 摩尔物质溶解时释放或吸收的热量称为 溶液热Q解决方案 根据热力学第一定律 Q解决方案 = ΔH解决方案, 其中 ΔH解决方案 是一定量的物质溶解时的焓变化。 无水白色硫酸铜在水中的溶解导致出现强烈的蓝色。 溶剂化物的形成、颜色变化、热效应以及许多其他因素表明溶液在其形成过程中的化学性质发生了变化。 因此,根据现代概念,溶解是一种物理化学过程,其中物理和化学类型的相互作用都起作用。 13. 溶解过程的热力学 根据热力学第二定律,在 p,T = const 时,如果由于这一过程,系统的吉布斯能量减小,物质可以自发溶解在任何溶剂中,即 ΔG = (ΔН - TΔS) < 0。 ΔН 的值称为焓因子,TΔS 的值称为溶解熵因子。 当液体和固体物质溶解时,系统的熵通常会增加(ΔS > 0),因为溶解的物质会从较有序的状态转变为较不有序的状态。 有助于增加溶解度的熵因子的贡献在高温下尤其明显,因为在这种情况下,因子 T 很大,乘积 TΔS 的绝对值也很大,吉布斯的减少能量增加。 当气体溶解在液体中时,系统的熵通常会降低(ΔS < 0),因为溶质会从不太有序的状态(大体积)变为更有序的状态(小体积)。 温度降低有利于气体的溶解,因为此时因子 T 较小,乘积 TΔS 的绝对值越小,吉布斯能量的下降越大,T 值越低。 在溶液形成过程中,系统的焓也可以增加(NaCl)和减少(KOH)。 根据赫斯定律,溶解过程的焓变化必须被视为伴随溶解过程的所有过程的吸热和放热贡献的代数和。 这些是物质晶格破坏、分子键断裂、溶剂初始结构破坏的吸热效应,以及包括溶剂化物在内的各种相互作用产物形成的放热效应。 为简单起见,溶解焓增量ΔН解决方案 可以表示为能量差 ECR, 消耗在溶解物质晶格的破坏上, 能量 E盐,在溶剂分子溶解溶质颗粒的过程中释放。 换句话说,焓变是焓变ΔH的代数和CR 由于晶格的破坏和焓的变化ΔН盐 由于溶剂颗粒的溶剂化: ΔN解决方案 = ΔHCR + ΔH盐, 其中 ΔH解决方案 - 溶解过程中的焓变。 然而,惰性气体在有机溶剂中的溶解往往伴随着热量的吸收,例如丙酮、苯、乙醇和环己烷中的氦和氖。 当溶解具有分子晶体结构的固体和液体时,分子键不是很牢固,因此通常ΔH盐 > ΔNCR 这导致了这样一个事实,例如,醇和糖的溶解是一个放热过程(ΔН解决方案 <0)。 当溶解具有离子晶格的固体时,能量比 ECR 和 E盐 可能不同。 然而,在大多数情况下,离子溶剂化过程中释放的能量并不能补偿用于破坏晶格的能量;因此,溶解过程是吸热的。 因此,热力学数据可以根据热力学第一和第二定律预测各种物质的自发溶解。 14. 溶解度 如果溶质与溶剂接触,溶液形成过程在许多情况下会自发进行,直到达到某个极限浓度(发生饱和)。 这发生在达到平衡时,当焓和熵因子相等时,即 ΔН = TΔS。 例如,当晶体被引入液体时,分子或离子从晶体表面进入溶液中。 由于扩散,颗粒均匀分布在整个溶剂体积中。 溶解进行到饱和。 在给定温度下含有最大量溶质并与过量溶质平衡的溶液称为饱和溶液。 过饱和溶液是浓度高于饱和溶液的溶液。 浓度低于饱和溶液的溶液称为不饱和溶液。 物质溶解在特定溶剂中的能力称为溶解度。 从数值上看,物质的溶解度等于其饱和溶液的浓度。 溶解度可以用与浓度相同的单位来表示,例如,用 1 升饱和溶液中所含溶质的量,mol/l 或 100g 饱和溶液中溶质的质量来表示. 溶解度的单位是克每 100 克溶剂。 相应的值称为溶解度系数。 溶解度取决于溶质和溶剂的性质、温度、压力以及溶液中其他物质的存在。 对组分性质溶解度的影响 物质溶解的能力取决于溶液 X 成分分子之间相互作用力的性质1 他们2 : 溶剂 - 溶剂 (X1 -X1 ), 溶质 - 溶质 (X2 - X2 ), 溶剂 - 溶质 (X1 - X2 )(点表示分子键)。 物质的溶解度变化很大。 这些例子显示了不同盐在相同溶剂(水)中的溶解度和相同物质(AgNO)的溶解度3 ) 在各种溶剂中。 具有离子键的物质和由极性分子组成的物质在水、醇等极性溶剂中的溶解度更好。 这些溶剂的特点是介电常数高。 物质的高溶解度通常是由于形成分子间键,特别是氢键。 因此,水和醇分子之间形成氢键可以解释水和醇的无限互溶性,而 Agcl 晶体在氨水溶液中的溶解可以通过化学供体-受体键的形成来解释。带有氨分子的银离子(AgCl 几乎不溶于水)。 出于同样的原因,吡啶这种低介电常数的溶剂表现出非常高的溶解度。 由于溶解度表征了真正的平衡,因此可以使用 Le Chatelier 原理定性地估计外部条件对这种状态(压力、温度)的影响。 在深潜实践中,在热店工作等时,此类评估是必要的。 15. 气体在液体中的溶解度。 亨利-道尔顿定律和谢切诺夫定律 气体在液体中的溶解几乎总是伴随着热量的释放。 因此,根据 Le Chatelier 原理,气体的溶解度随着温度的升高而降低。 这种模式通常用于通过煮沸从水中去除溶解的气体(例如 CO02)。 有时气体的溶解伴随着热量的吸收(例如惰性气体在某些有机溶剂中的溶解)。 在这种情况下,提高温度会增加气体的溶解度。 气体不会无限期地溶解在液体中。 在一定的气体浓度 X 下,建立了一个平衡:  当气体溶解在液体中时,系统的体积会显着减小。 因此,根据 Le Chatelier 原理,压力的增加应该导致平衡向右移动,即气体的溶解度增加。 如果气体在给定的液体中微溶且压力低,则气体的溶解度与其压力成正比。 亨利定律 (1803) 表达了这种依赖性: 在给定温度下,在一定体积的平衡液体中溶解的气体量与气体压力成正比。 亨利定律可以写成以下形式: с (X) =Kr(X) ×P(倍) 其中是饱和溶液中气体的浓度,mol/l; P(倍) ——溶液上的气体压力 X,Pa; Kr(X) - 气体 X 的亨利常数,mol × l1 × Pa1 . 亨利常数取决于气体、溶剂和温度的性质。 亨利定律仅适用于相对稀的溶液,在低压和溶解气体分子与溶剂之间没有化学相互作用的情况下。 亨利定律是一般道尔顿定律的一个特例。 如果我们谈论的不是一种气态物质的溶解,而是气体混合物的溶解,那么每个组分的溶解度都遵循道尔顿定律: 气体混合物中各组分在恒温下的溶解度与该组分在液体上方的分压成正比,不取决于混合物的总压力和其他组分的个体性。 换句话说,在气体混合物溶解在液体中的情况下,分压 p! 这个组件。 组分的分压被理解为组分的压力与气体混合物的总压力的比例: Рi/R社会 组件的分压由公式计算 俄罗斯生理学家 I. M. Sechenov (1829-1905) 研究气体在有电解质的液体中的溶解度,建立了以下模式(谢切诺夫定律):在有电解质的情况下,气体在液体中的溶解度降低; 气体被释放。 Рi = P.社会 ×(Xi) 其中 pi - 组分 X 的分压i; Р社会 气体混合物的总压力; x(Xi) 是第 i 个组分的摩尔分数。 俄罗斯生理学家 I. M. Sechenov (1829-1905) 研究气体在有电解质的液体中的溶解度,建立了以下模式(谢切诺夫定律):在有电解质的情况下,气体在液体中的溶解度降低; 气体被释放。 16. 扩散在生物系统中物质转移过程中的作用 扩散在生物系统中起着重要作用。 首先,组织液中营养物质和代谢产物的运动是通过扩散发生的。 此外,在许多情况下,生物体中的物理化学过程的速率取决于反应物的扩散速率,因为反应物的扩散通常是该过程中最慢的阶段,而涉及酶的生化反应进行得非常快。 每个活细胞都被一层膜包围,用于保护和调节细胞内环境。 物质通过两种主要机制穿过膜:通过普通扩散(被动运输)和通过能量激活转移(主动运输)。 膜的内层由烃链组成。 因此,许多小的中性分子和非极性 HMS 分子可溶于该层,并可以沿浓度梯度通过正常扩散穿过膜。 这种物质的运输被称为被动运输。 扩散在肺部血液的氧合过程中起着重要作用。 由于分支大,肺泡表面大(~80 m2),因此氧气积极溶解在血浆中并进入红细胞。 静脉血中的氧气耗尽 - 静脉血中的氧气浓度趋于零。 因此,大气和进入肺部的血液之间的氧浓度梯度很高,导致主动摄取(根据菲克定律)。 物质逆着梯度从浓度较低的区域向浓度较高的区域运动称为主动运输。 这样的过程不能自发地进行并且需要能量成本。 能量来源是生物无机化合物-三磷酸腺苷 (ATP) 的放热水解反应。 当通过膜进入细胞的 K 离子流量与由于被动扩散而从细胞中流出的 K 离子流量相等时,细胞内外的 K 离子浓度就实现了稳定的静态分布。 Na 离子的分布(离子稳态)类似地实现,只有离子的主动传输和补偿被动扩散与 K 离子的相应流动相反。 扩散过程广泛用于医学。 例如,在临床实践中使用基于低分子量物质沿浓度梯度通过半透膜的选择性扩散的透析方法来创建“人工肾”装置。 宫内节育器颗粒不通过半透膜,因此生物体液(例如血浆)可以通过透析从有害的低分子物质-“渣”(尿素、尿酸、胆红素、胺、过量的 K 离子)中纯化出来积累在各种疾病中。 在净化过程中,从静脉抽取的患者血液进入带有半透膜的特殊腔室,NMS 可以通过半透膜扩散并从血浆中去除。 在许多炎症性疾病中,会发生蛋白质破坏,并且在血浆中,与 NMS 一起,还需要去除蛋白质片段(肽和多肽)。 17、降低溶液的冰点和提高溶液的沸点 降低溶液上的蒸气压的直接后果是冰点的变化 ΔТз 和溶液的沸点ΔТк 与纯溶剂的这些量的值相比。 这些量之间的关系也遵循热力学第二定律。 液体的沸点是其蒸气压与外界压力相等时的温度(例如,在 101,3 kPa 时,水的沸点为 100°C)。 液体的凝固点(结晶)是液体上的蒸气压等于固相上的蒸气压的温度。 如果我们指定溶液 T3 和 Tk 的冰点和沸点,与溶剂 T° 相同的值3 和 T°к ,那么我们得到: ΔTk = Tк - 温度°к > 0, ΔT3 = T°3 - T.3 > 0。 使用 Le Chatelier 原理可以定性地解释提高溶液沸点和降低溶液凝固点的效果。 事实上,如果在一个平衡系统“液体 - 蒸汽”(例如,H2О(g) - H2О(G)),引入可溶性非挥发性物质,则溶液上溶剂的蒸气压会降低。 为了补偿蒸气压的降低并达到先前的平衡状态,必须将溶液加热到更高的温度(超过 373°K),因为该过程是吸热的。 假设有一个平衡系统“固相-液体”,例如 H2О(T) > 高2О(g), 在 273°K。 如果一定量的不挥发物质(不溶于固相)溶解在液相中,那么液相中水分子的浓度就会降低。 根据勒夏特列原理,一个过程将开始增加液相中的水量——冰的融化。 为了建立新的平衡,必须冷却溶液,即必须降低温度,因为该过程是放热的。 根据稀溶液的拉乌尔定律,蒸气压的降低与溶液的浓度成正比。 因此,此类溶液的沸点升高和冰点降低应随着其浓度的增加而增加。 研究溶液的冷冻和沸腾,劳尔发现:沸点 ΔT 升高к 并降低冰点ΔT3 非电解质的稀溶液与溶液的摩尔浓度成正比: ΔTк =Kэb(X), ΔT3 = Kз b(X), 哪里 b(倍) - 摩尔浓度,mol/kg; Кз 和Kэ - 比例系数, kg × K × mol1 ,分别称为沸腾常数和低温常数。 常数 K 的物理意义э 和Kз 如果我们接受 b(倍) = 1. 那么 Kэ = ΔTк , 和 Kз = ΔTз . 换句话说,沸腾常数在数值上等于一摩尔溶液沸点的升高,而低温常数在数值上等于一摩尔溶液的凝固点降低。 沸点和低温常数仅取决于溶剂的性质,而不取决于溶质的性质(理想溶液)。 18. 渗透压 渗透是溶剂分子通过半透膜从溶剂进入溶液或从较低浓度的溶液进入较高浓度的溶液的主要单向渗透(扩散)。 发生渗透的必要条件是存在溶剂和不同浓度的溶液或两种溶液,由半透膜隔开。 从热力学的角度来看,渗透的驱动力是系统平衡浓度的趋势,因为在这种情况下系统的熵增加,因为系统进入不太有序的状态,系统的吉布斯能量相应地减小,并且化学势相等。 因此,渗透是一个自发的过程。 一个简单的实验可以说明渗透机制与溶液中蒸气压变化之间的联系。 如果将装有纯溶剂的玻璃杯和装有某种非挥发性物质溶液的玻璃杯(容器中的液位相同)放在密闭的玻璃容器中,过一会儿,容器中的液位第一个玻璃杯会减少,第二个玻璃杯中的溶液水平会增加。 在这种情况下,溶剂从第一个烧杯流到第二个烧杯,这是由于(根据拉乌尔定律)溶液中溶剂的蒸气压低于纯溶剂上的蒸气压。 因此,溶剂和溶液之间的空气空间充当半透膜。 让我们用葡萄糖水溶液填充一个具有半渗透壁的容器,然后将其放入另一个装有水的容器中,以使这些容器中的液体高度一致。 由于渗透作用,第一个容器中溶液的体积增加,该容器中的液位逐渐上升。 这会产生额外的静水压力,防止渗透。 渗透平衡时液柱的静水压力决定了溶液的渗透压。 渗透压 称为由必须施加到溶液以停止渗透的最小液压测量的值。 渗透压定律。 Van't Hoff 提出了一个计算非电解质稀溶液渗透压的经验方程: π = C(X)RT, 式中 π——渗透压,kPa; С(X) - 摩尔浓度,mol/l; R 是通用气体常数,等于 8,31 kPa - l / (mol - K); T 是绝对温度,K。 范特霍夫定律虽然是根据实验数据建立的,但可以从ΔG = 0时的热力学平衡条件推导出来。因此,该定律应被认为是热力学第二定律的结果。 上述形式的表达式类似于理想气体的 Clapeyron-Mendeleev 方程,然而,这些方程描述了不同的过程。 19、渗透和渗透压在生物系统中的作用 渗透现象在许多化学和生物系统中起着重要作用。 渗透调节水流入细胞和细胞间结构。 细胞的弹性(膨压),保证组织的弹性和器官一定形状的保存,是由于渗透压。 动植物细胞具有壳或原生质表层,具有半透膜的特性。 当将这些细胞置于不同浓度的溶液中时,会观察到渗透作用。 具有相同渗透压的溶液称为等渗溶液。 如果两种溶液具有不同的渗透压,则渗透压高的溶液相对于第二种溶液是高渗的,而第二种溶液相对于第一种溶液是低渗的。 当细胞置于等渗溶液中时,它们会保持其大小和正常功能。 当细胞置于低渗溶液中时,来自浓度较低的外部溶液的水会进入细胞,导致细胞肿胀,然后导致细胞膜破裂和细胞内容物流出。 这种细胞的破坏称为溶解,在红细胞的情况下,这个过程称为溶血。 溶血过程中流出的含有细胞内容物的血液因其颜色而被称为清漆血。 当将细胞置于高渗溶液中时,水会在更浓缩的溶液中离开细胞,并观察到细胞起皱(干燥)。 这种现象称为质壁分离。 人体生物体液(血液、淋巴液、组织液)是低分子化合物的水溶液 - NaCl、KCl、CaCl,高分子化合物 - 蛋白质、多糖、核酸和有形成分 - 红细胞、白细胞、血小板。 它们的总作用决定了生物体液的渗透压。 人体血液在 310°K (37°C) 时的渗透压为 780 kPa (7,7 atm)。 相同的压力由 0,9% NaCl 水溶液 (0,15 mol/l) 产生,因此与血液(生理盐水)等渗。 然而,除了Na和C1离子外,血液中还有其他离子,还有宫内节育器和有形成分。 因此,出于医学目的,使用与构成血液的成分相同且数量相同的溶液更为正确。 这些溶液在手术中用作血液替代品。 人体除了渗透压外,还具有恒定性(体内平衡)和血液的其他物理化学指标,例如酸度。 血液渗透压的允许波动非常小,即使在严重的病理情况下也不超过几十 kPa。 在各种程序中,只有等渗溶液才能大量注入人和动物的血液中。 对于大量失血(例如,在大手术、受伤后),患者会被注射几升等渗溶液,以用血液来补偿液体的损失。 渗透现象在医学实践中得到广泛应用。 因此,在手术中,使用高渗敷料(纱布浸泡在 10% 高渗 NaCl 溶液中),将其注射到化脓性伤口中。 根据渗透定律,通过纱布的伤口液流向外引导,因此伤口不断清除脓液、微生物和腐烂产物。 20. 解离度(电离)。 电解质的强度 几乎完全离解成离子(电离)的电解质称为强电解质,未完全电离的电解质称为弱电解质。 在弱电解质溶液中,除了离子,还有非电离分子。 正是通过不完全电离,S. Arrhenius 解释了为什么弱电解质溶液的等渗系数不等于整数。 为了定量表征解离的完整性,引入了解离(电离)程度的概念。 电解质的离解(电离)程度是分解成离子的分子数与其引入溶液中的分子总数之比。 换句话说,an 是电解质分子分解成离子的比例。 解离度 an 表示为一个单位的百分比或分数: αн = N.н/ N.p, 其中 N 是分解成离子的电解质分子数; Np 引入溶液(溶解)的电解质分子的数量。 所以对于 C(CHXNUMXCOOH) = 0,1 mol/l,解离度 αн = 0,013(或 1,3%)。 根据离解程度,电解质通常分为强(αн > 30%) 和弱 (αн < 3%)。 在该区间内,电解质被认为具有中等强度。 几乎所有的盐都被认为是强电解质。 在最重要的酸和碱中,H2SO4 , HCI, HBr, HI, HNO3 , 氢氧化钠, KOH, Ba(OH)2 . 弱电解质包括大部分有机酸,以及一些无机化合物-H2S、HCN、N2CO3 , 所以3 , HCl0, N2上3IN3 , 汞2CI2 , 铁(SCN)3 . An 通过测量电解质溶液的整理性质与理想溶液的理论依赖性的偏差来实验确定。 例如,通过低温法确定等渗系数i,然后计算解离度。对于强电解质,解离度很明显,因为它们几乎完全解离成离子。 对他们来说,等渗系数 i 与整数知识的偏差不是由溶液中存在未结合的分子,而是由其他原因来解释。 解离伴随着热量的释放或吸收。 因此,解离程度必须取决于温度。 可以根据 Le Chatelier 原理估计温度的影响。 如果电解离解是在吸收热量时发生的,那么随着温度的升高,a 会增加,如果随着热量的释放,a 会降低。 电解离解的程度受溶液浓度的影响。 当溶液被稀释时,解离度显着增加。 在这方面,根据离解程度 α 对电解质强度的指示分类н 仅适用于浓度约为 0,1 mol/l 的溶液。 如果我们把电解解离看作是一个平衡可逆的过程,那么根据勒夏特列原理,用水稀释会增加蒸馏分子的数量,即解离度增加。 弱电解质的离解程度也受到同名离子的影响。 因此,在平衡系统中引入弱电解质会增加离子浓度,根据 Le Chatelier 原理,这会导致离解平衡显着向左移动,即离解程度降低. 因此,将同名离子添加到弱电解质溶液中会降低其离解程度。 21. 解离常数。 奥斯特瓦尔德育种法则。 强电解质溶液理论 定量地,作为平衡可逆过程的电解解离可以通过质量作用定律确定的解离(电离)常数来表征。 严格来说,质量作用定律适用于可逆反应,即适用于弱电解质溶液。 例如,KtnAnm 电解质的解离可以表示为一个平衡过程: Ktn Anm × nKtm+ + 毫安n . 根据质量作用定律,平衡常数写为: КД = (Ktm+)n+(一个n)m + (KtnAnm) 其中(Ktm+) 和n ) - 电解质离子的摩尔平衡浓度; (KtnAnm) 是未解离电解质分子的摩尔平衡浓度; КД 是平衡常数,称为解离常数。 该方程仅适用于弱电解质的稀溶液。 当将其应用于浓溶液和强电解质溶液时,必须修改方程。 解离常数 K 越大Д ,电解质解离得越多。 与解离度 K 相比Д 只取决于溶剂、电解质和温度的性质,而不取决于溶液的浓度。 因此,电解离解的常数和程度都是离解的定量特征。 自然,他们之间是有联系的。 多元酸和多元酸碱逐步解离。 例如,磷酸的解离发生在三个步骤中:  对于多元酸碱(例如,Ca (OH)2) - 解离发生在两个阶段。 逐步解离的特征在于,电解质在每个后续阶段的分解程度都比前一个阶段要小。 解离常数变化的这种特征可以根据库仑定律通过静电引力来解释。 当离子与中性电解质分子分离时,电离能最小。 在解离的每个下一步中离子的分离需要增加能量,因为离子的去除发生在粒子的电荷在随后的步骤中变得更大。 物理和物理化学研究方法证实,无论溶液浓度如何,强电解质几乎完全离解成离子。 因此,稀溶液中强碱对所有强酸的中和热值几乎相同。 无论酸和碱的性质如何,都得到相同的 AH = 56,5 kJ / mol 值。 这一事实清楚地证明了酸和碱的稀溶液完全解离。 在所有情况下,中和过程中发生的常见过程是 mol 中离子的组合 22. 酸碱理论 许多电解质,特别是各种元素 E 的氢氧化物,表现出酸或碱的性质。 EON氢氧化物的解离可以以两种方式进行: 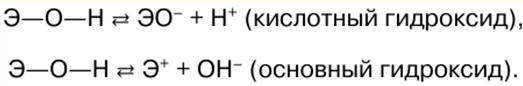 间隙可以沿着基团的两个键发生 E-O-N。 众所周知,键的极性和强度取决于元素的电负性差异、原子的大小和有效电荷。 如果 O-H 键的断裂能远小于 E-O 键的断裂能,则氢氧化物的解离根据酸的类型进行。 相反,如果 O-H 键的断裂能量远大于 E-O 键的断裂能量,则解离按主要类型进行。 在碱金属和碱土金属的氢氧化物,以及低氧化态的过渡金属中,E-O键的强度较低,氧与氢的键合更牢固,E-O-H解离主要按照碱性类型进行,即用氢氧化二酮消除。 这是因为这些元素的离子尺寸较大,有效电荷较小,即极化能力较弱。 随着氧化程度的增加,E 原子的极化效应增加(比电荷增加),氧与元素 E 的结合更牢固,E-O-H 的离解主要根据酸类型进行,即, 氢离子被分离出来。 后者与氧原子处电子密度的重新分布有关。 结果,E-O键变强,而O-H键变弱。 目前,酸和碱的概念没有明确的定义,它同样可以用来表征任何溶剂中的酸碱相互作用。 为了表征水溶液中的许多电解质,仍然可以使用 Arrhenius 给出的酸和碱的概念: 1) 酸是在溶液中解离形成氢离子 H 的电解质; 2) 碱是一种电解质,在溶液中解离形成 OH 氢氧根离子; 3)两性电解质(两性氢氧化物)是在溶液中解离形成氢离子和氢氧根离子的电解质。 两性电解质包括锌、铝、铬和其他两性元素的氢氧化物,以及氨基酸、蛋白质、核酸。 将 Le Chatelier 原理应用于酸碱平衡链表明,随着系统中 OH 氢氧根离子浓度的增加,酸型解离的概率增加。 根据主要类型,系统中氢离子 H+ 浓度的增加导致主要解离。 这意味着在酸性环境中,角闪石呈现碱性特征,而在碱性环境中,它呈现酸性特征。 例如,氢氧化锌在与酸相互作用时表现得像碱: 锌(OH)2 + 2HCI - 氯化锌2 +2Н2哦, 当与碱相互作用时 - 作为酸: 锌(OH)2+ 2NaOH → 钠2[锌(OH)4]. 23. 血液缓冲系统、血浆 缓冲系统对于维持生物体的酸碱平衡非常重要。 所有生物体的细胞内和细胞外液都具有恒定的 pH 值,这在缓冲系统的帮助下得以维持。 大多数细胞内液的 pH 值在 6,8 到 7,8 之间。 人体血液中CO平衡的酸碱平衡由碳酸氢盐、磷酸盐和蛋白质缓冲系统提供。 血浆的正常pH值为7,40±0 05。这对应于3,7至4,0x108 mol/l的活性酸度值范围。 由于血液中有各种电解质(HC03 , H2CO3 ^ h2RO4 , NRO42 )、蛋白质、氨基酸,这意味着它们解离的程度使得 (H +) 的活性在指定范围内。 由于血浆和血细胞中无机和有机物质的含量不同,建议将这些血液成分分开考虑。 血浆 HCO 缓冲系统3 / H2CO3 由碳酸组成2CO3 和共轭碱基 HCO3 . 它是血液中最重要的缓冲系统。 成分之一是碳酸H2CO3 - 由溶解在血浆中的 CO 相互作用形成2 与水: CO2(r) + N.2何宁2CO3. 其中 CO2(r) - 溶解的 CO 浓度2 . 该反应的平衡常数为: K = [N2CO3] / [一氧化碳2] 一氧化碳之间2 在流过肺毛细血管的血浆中的肺泡和碳酸氢盐缓冲液中,建立了一个平衡链。 碳酸氢盐缓冲系统在 pH 7,4 附近充当有效的生理缓冲剂。 进入酸的血液 - H 的供体+ 由于 HCO 离子,根据 Le Chatelier 原理,链中的平衡向左移动3 将 H 离子结合成 H 分子2CO3 . 同时,H 浓度2CO3 增加,HCO 离子浓度3 下跌降落。 增加 H 浓度2CO3 导致平衡向左移动,(勒夏特列原理)。 它会导致腐烂2CO3 和二氧化碳浓度的增加2 溶于血浆。 结果,平衡向左移动,CO 的压力增加。2 在肺部。 过量的二氧化碳2 从体内排出。 结果,血液中的碳酸氢盐系统迅速与一氧化碳平衡2 在肺泡中并有效地维持血浆pH值的恒定性。 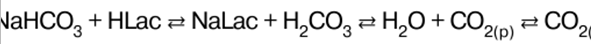 因此,维持正常的血液 pH 值,但由于酸中毒,pH 值略有明显变化。 在封闭的空间里,他们经常感到窒息(缺氧),呼吸增加。 然而,窒息与其说是缺氧有关,不如说是与过量的二氧化碳有关。 过量的二氧化碳2 根据亨利定律,在大气中会导致 CO 进一步溶解2 在血液中。 这会导致血液 pH 值降低,即酸中毒。 碳酸氢盐缓冲系统对血液 pH 值的变化反应最快。 其酸缓冲能力为Vк \u40d XNUMX mmol/l 血浆,对碱的缓冲能力要小得多,约等于 Vщ = 1-2 mmol/l 血浆。 24. 中和反应 中和反应称为酸和碱相互作用的交换反应,结果形成盐和水。 考虑不同类型的中和反应。 1、强酸中和强碱: 氢氧化钾 + 硝酸3 - 硝酸钾3 + N.2O. 这种反应的分子离子方程式 H+ + 哦 → N2O 和吉布斯能量ΔG°的负值表明平衡实际上向水的形成移动。 中和反应的一个常见情况是强度(解离度)不同的酸和碱的相互作用。 由于盐水解的逆反应,这些反应不会完成。 2、弱酸与强碱的中和:  或以分子形式:  在这种情况下,中和反应是可逆的。 弱碱与强酸的中和反应也是可逆的:  或以分子形式: 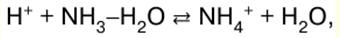 还有 - 带有弱酸的弱碱: 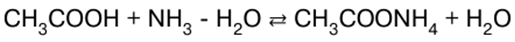 或以分子形式:  在这些系统中,平衡强烈向右移动,因为水是比氢氰酸、氨和乙酸弱得多的电解质。 中和反应形成中和方法的基础。 该方法在临床实验室中用于确定胃液的酸度、血浆的缓冲能力。 在药理学中,用于无机酸(盐酸、硫酸、硼酸)和有机酸(乙酸、苯甲酸、酒石酸、柠檬酸、水杨酸)的定量分析。 在生物制药研究中,酸的 pKa 和碱的 pKa 是通过中和来确定的,因为这些值的值可以预测药物通过生物膜的能力。 酸碱滴定法用于测定 pKа 氨基酸和pKа 蛋白质中的解离基团。 在两个不同温度下获得的蛋白质滴定曲线可用于确定羧基、咪唑和其他基团的数量。 氨基酸和蛋白质的滴定使得确定它们的等电点成为可能。 水解是物质被水分解。 各种类别的化合物都可以进行水解:蛋白质、脂肪、碳水化合物、酯、盐等。在无机化学中,它们最常遇到盐的水解。 25.盐水解 盐水解 - 这是盐与水分子的相互作用,导致形成低离解化合物。 水解过程包括质子从水分子转变为给定离子(CO32 + HOH * HCO3+ 哦 ) 或从给定的离子,包括从水合金属阳离子,到水分子。 根据盐的性质,水既可以作为酸也可以作为碱,盐分别是共轭碱或共轭酸。 取决于盐的类型,水解的四种变体是可能的。 1.强酸弱碱形成的盐类:  2.强碱和弱酸形成的盐: CH3COONa + HOH → CH3二氧化碳 + 氢氧化钠。 3.由弱酸和弱碱形成的盐。 氰化铵通过以下反应水解: 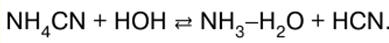 4.由强酸和强碱形成的盐。 NaCl、KNO3 不发生水解。 盐水解的机理在于盐离子与其水合壳的极化相互作用。 这种相互作用越强,水解进行得越强烈。 所有考虑的水解情况都涉及由一酸碱和一酸形成的盐。 多元酸和多元酸碱的盐分步水解,形成酸性盐和碱性盐。 定量地,水解作为 CO 平衡的特征在于水解程度和水解常数。 水解度是通过水解物质的量与溶质总量的比值来衡量的。 水解程度取决于盐的性质、浓度和温度。 根据质量作用定律,水解程度随着溶液的稀释而增加。 所以,在浓度 Na2CO3 0,001 mol/l,水解度为34%。 在一般情况下,以下规律是正确的。 1.盐的水解应随着温度的升高和溶液的稀释而增加。 2. 在可逆水解中,根据 Le Chatelier 原理,该过程应通过酸化(如果这种盐由强酸和弱碱形成,H 离子积累)或碱化(如果盐是由弱酸强碱,OH 离子积累)。 3. 盐的水解是不可逆的,盐的水解会导致形成溶解度差的或气态的产物,这些产物会从反应球中排出(平衡位移原理)。 例如,Pb(SO4)2 完全是由于形成了 PbO 沉淀物2: 铅(SO4)2 +2Н2O→PbO2 + 2H2SO4. 水解是许多类别的无机和有机化合物的特征。 无机化合物的水解对于评估其毒性很重要。 有机化合物的水解用于从木材、脂肪、酯类和其他物质中获得有价值的产品,但水解在生物体的生命中起着特别重要的作用。 26. 沉淀溶解反应 电解液中发生的交换反应包括沉淀反应和溶解反应。 沉淀反应伴随着沉淀。 伴随沉淀溶解的反应称为溶解反应。 由微溶电解质的沉积物和其上方的饱和溶液组成的系统被广泛使用。 在这样的系统中,饱和溶液和沉淀物之间建立了动态平衡。 由于溶解度低,微溶电解质在溶液中的浓度很低,因此可以认为它在溶液中完全解离了。 换言之,在饱和溶液中,物质的固相与进入溶液中的离子之间建立了动态平衡。 例如,在 AgCl 的饱和溶液中,会发生以下平衡: 氯化银(T) → 银+(p) + Cl(右). 作为常数值的固相 AgCl 的浓度从平衡常数的表达式中排除。 因此,平衡常数仅由溶液中离子浓度的乘积决定,称为常数或溶解度积。 在一般情况下,对于 Ktn Anm 电解质,溶解度常数由离子浓度的化学计量乘积确定: К等等= [Ktm+ ]n[一个n]m 该值表征了电解质在没有外来物质的恒定温度下的溶解度。 K 恒常性等等 并不意味着溶液中单个离子的浓度恒定。 因此,可以通过添加例如 AgNO 来增加 AgCl 饱和溶液中的 Ag 离子浓度3 ,而根据 Le Chatelier 原理的平衡将向左移动,这将导致离子沉积速率的增加。 一段时间后,AgCl 的溶解速率和 Ag 和 Cl 离子的沉淀将变得相等。 与以前一样,新建立的均衡将由值 K 表征等等(AgCl),但 Ag 和 Cl 离子的平衡浓度会发生变化。 因此,基于 K等等 可以根据两个规则预测电解质沉淀物的形成和溶解。 1. 当溶液中离子浓度的化学计量乘积大于溶解度常数时,电解质会沉淀。 2. 当溶液中其组成离子浓度的化学计量乘积小于溶解度常数时,电解质沉淀溶解。 沉淀反应构成了药物定量分析中沉淀法的基础。 沉淀法用于临床分析尿液、胃液、血液中的氯化物,在卫生和卫生实践中 - 用于分析饮用水。 科学家认为,元素的天然化合物在水中的不同溶解度对其在生物体中的含量有很大影响。 化合物在水中的溶解度与许多元素离子的毒性作用之间存在密切关系。 例如,Al 的引入3 + 由于形成难溶性磷酸铝 AlPO4 而进入体内 27. 氧化还原反应 无机化学的基本概念之一是氧化态(CO)的概念。 化合物中元素的氧化态是元素原子的正式电荷,是根据价电子传递到具有较高相对电负性 (REO) 的原子并且化合物分子中的所有键都是离子的假设计算得出的。 元素E的氧化态在元素符号上方的顶部用数字前的“+”或“-”符号表示。 溶液或晶体中实际存在的离子的氧化程度与它们的电荷数相符,类似地在数字后用符号“+”或“-”表示,例如Cl,钙2+. Stock 法也用于在元素符号后用罗马数字表示氧化程度:Mn (VII)、Fe (III)。 分子中原子氧化态符号的问题是在比较形成分子的互连原子的电负性的基础上解决的。 在这种情况下,电负性较低的原子具有正氧化态,电负性较高的原子具有负氧化态。 需要注意的是,氧化态不能与元素的化合价等同。 价,定义为给定原子与其他原子相连的化学键数,不能为零,也没有“+”或“-”符号。 氧化态可以有正值和负值,也可以是零值甚至分数值。 例如,在 CO 分子中2 C的氧化态为+4,在CH分子中4 C 的氧化态为 4。两种化合物中碳 4 a 的化合价均为 IV。 尽管存在上述缺点,但在化合物分类和氧化还原反应方程式的制定中,使用氧化度的概念是方便的。 当元素被氧化时,氧化态增加,换句话说,反应过程中的还原剂增加了氧化态。 相反,当元素被还原时,氧化态降低,即在反应过程中,氧化剂降低了氧化态。 因此,可以给出以下氧化还原反应的公式:氧化还原反应是随着构成反应物质的元素原子的氧化态变化而发生的反应。 28.氧化剂和还原剂 为了预测氧化还原反应的产物和方向,记住典型的氧化剂是原子具有大 EER> 3,0 的简单物质(VIA 和VIIA 基团的元素)是有用的。 其中,最强的氧化剂是氟(OEO = 4,0)、氧(OEO = 3,0)、氯(OEO = 3,5)。 重要的氧化剂包括 PbO2 ,KMnO4 , Ca(SO4)2 , 至2铬2O7 , 盐酸, 盐酸3, KSIO4, 钠生物3, H2SO4(结尾),HNO3(结束) ,娜2O2 ,(NH4)2S2O8 , KSIO3 , H2O2 和其他含有更高或更高CO原子的物质。 典型的还原剂包括其原子的 EER < 1,5 的简单物质(IA 和 IIA 组的金属以及一些其他金属)。 重要的还原剂包括 H2S,NH3, HI, KI, SnCl2 , 硫酸铁4 、C、H2 ,CO,H2SO3 铬2(SO4)3 , 氯化铜, 钠2S2O3 和其他含有低 CO 原子的物质。 分别含有最大和最小氧化态原子的物质只能是氧化剂,例如,K2SG2O7 , 国民党4 铅2 , 盐酸4 或仅还原剂,例如 NH3 , H2S,你好。 含有中间氧化态原子的物质既能升高也能降低氧化态,即它们既可以是还原剂(在比它们更活泼的氧化剂的作用下),也可以是氧化剂(在比它们更活泼的氧化剂的作用下)。比它们更活泼,还原剂)。 这种物质表现出氧化还原二元性。 在编制氧化还原反应方程式时,可以使用两种方法:电子平衡法和离子电子法(半反应法)。 离子电子法给出了溶液中氧化还原过程更正确的想法。 借助这种方法,可以预测实际存在于溶液中的离子和分子会发生变化。 除了预测反应产物外,离子半反应方程对于理解电解过程和原电池中发生的氧化还原过程是必要的。 这种方法反映了环境作为过程参与者的角色。 最后,在使用这种方法时,不必事先知道所形成的所有物质,因为其中许多物质是通过编制氧化还原反应方程式获得的。 应该记住,虽然半反应反映了氧化还原反应过程中发生的真实过程,但它们不能与氧化还原反应的真实阶段(机制)相识别。 许多因素影响氧化还原反应的性质和方向:反应物的性质、介质的反应、浓度、温度和催化剂。 应该记住,负值并不总是导致对给定方向上的实际反应过程做出明确决定,因为还需要考虑动力学因素。 29. 氧化还原过程的生物学意义 氧化还原反应是伴随电子从一个分子或离子转移到另一个分子或离子的化学过程。 在氧化还原反应中,会发生两个相互关联的过程:氧化和还原。 氧化是失去电子的过程。 恢复是添加电子的过程。 原子或离子提供电子的物质称为还原剂。 原子或离子添加电子(或将一对普通电子拉到自己身上)的物质称为氧化剂。 在锌与 CuSO 的反应中4 Cu2 + 添加电子: 他们自己2+ + 2e־ - 硅0 . 锌原子提供电子: Zn0 -锌2 + 2电子. 因此,CuSO4 - 氧化剂,Zn - 还原剂。 动物有机体中的重要过程是底物的酶促氧化反应:碳水化合物、脂肪、氨基酸。 由于这些过程,生物体获得了大量的能量。 成年男性大约 90% 的总能量需求由组织中碳水化合物和脂肪氧化过程中产生的能量提供。 其余的能量 - ~10% 是由氨基酸的氧化分解提供的。 在大量酶的参与下,生物氧化通过复杂的机制进行。 在线粒体中,由于来自有机底物的电子转移而发生氧化。 作为电子载体,线粒体的呼吸链包括各种蛋白质,这些蛋白质含有各种设计用于携带电子的官能团。 当它们沿着链从一个中间体移动到另一个中间体时,电子失去了它们的自由能。 对于通过呼吸链转移到氧气的每对电子,会合成 3 个 ATP 分子。 在将 2 个电子转移到氧的过程中释放的自由能为 220 kJ/mol。 在标准条件下合成 1 个 ATP 分子消耗 30,5 kJ。 由此可以清楚地看出,在一对电子转移过程中释放的相当大一部分自由能存储在 ATP 分子中。 从这些数据中,从初始还原剂到氧气的多级电子转移的作用也变得清晰起来。 在一对电子向氧的转移过程中释放的大能量 (220 kJ) 被分成对应于各个氧化阶段的多个部分。 在三个这样的阶段,释放的能量大约对应于合成 1 个 ATP 分子所需的能量。 氧化还原反应是氧化测定方法的基础,在临床分析中用于测定钙离子、尿酸、过氧化氢酶和过氧化物酶、血液中的糖分,并在卫生和卫生分析中测定水的氧化性、活性氯的含量漂白剂、家庭用水和饮用水中的余氯。水 30. 化学键及其实验特性 现代原子模型的发展以及在此基础上预测单个原子的性质是量子力学的一项非常重要的成就。 然而,在陆地条件下很少发现孤立的原子。 我们周围的无生命和有生命的自然界由各种分子组成。 A. M. Butlerov (1828-1886) 创立了有机物质的化学结构理论 (1861)。 从那时起,“化合价”和“化学键”的概念逐渐开始进入化学。 化合价是原子与一定数量的其他原子结合形成分子的能力。 化合价由元素符号旁边的破折号表示。 氢 (H) 是一价的,氧 (0= ) 是二价的。 价线的数量决定了给定原子可以与其他原子形成的化学键的数量。 化学键是电子和原子核之间的一组相互作用,导致原子结合成一个分子。 通过各种方法研究化学键的性质。 在化学方法的帮助下,确定原子键的数量(化合价)及其反应性。 使用物理方法确定化学键的长度、强度、方向和极性。 化学键长 rс 称为由结合原子核之间的距离测量的值。 作为化学键长g的单位с 方便使用皮米(pm):1 pm = 1012 米 化学键强度 Eс - 焓测量值 ΔЕс 连接形成。 作为化学键强度E的单位с 使用千焦/摩尔。 化学键取向aс - 通过给定原子的键方向与分子的相邻原子之间的角度测量的值。 角ac称为价角。 键角单位aс - 程度。 化学键极性 μс - 通过该连接的电力矩测量的值。 绝对值相等符号相反的两个电荷 +q 和 ־q 的电矩等于 μ = qr,其中 r 是电荷之间的距离。 这两个电荷形成一个电偶极子。 当 2 个具有不同电负性 (EEO) 的原子键合时,化学键会极化。 结果,在具有大 EER 的原子上出现过量的负电荷 δ,而在具有较小 EER 的另一个原子上出现过量的正电荷 +δ。 键的极性由下式计算: μс =δrс. 作为测量化学键极性的单位,使用系统外的德拜单位(D)- 1 D = 3,3 x 1030 C/m 比较方便。 水分子中O-H键的极性为μ他 = 1,5D。 对化学键的研究表明,在大多数情况下,同一化学键在不同化合物中的长度、强度、取向、极性具有大致相同的值。 因此,导致原子之间形成给定键的相互作用在不同分子中具有相同的性质。 化学键合的量子力学理论为这一事实提供了解释。 31. 氢键。 分子间和分子内氢键 分子中的化学键通常非常强,它们的能量在 100-150 kJ/mol 范围内。 此外,还有所谓的氢键,其强度为10-40 kJ/mol。 这些键的长度分别为 270-230 pm。 原子间的氢键 EА 和 EВ 称为由连接到 E 的氢原子进行的相互作用А 或 EВ 化学键。 在一般情况下,氢键的图像具有以下形式: ЭА-N...Eв.. 显然,氢键是三中心的,因为有 3 个原子参与了它的形成。 对于这种键的发生,原子 EА 和 EВ 具有高电负性。 这些是最负面元素的原子:氮 (REO = 3,0)、氧 (REO = 3,5)、氟 (REO = 4,0) 和氯 (REO = 3,0)。 由于 ls-AO 氢和两个 2pAO 原子 E 结合形成氢键А 和 EВ; 2个轨道沿一条直线定向。 因此,氢键是线性的。 氢键称为: 1) 分子内,如果原子 EА 和 EВ ,由该键连接,属于同一个分子; 2) 分子间,如果原子 EА 和 EВ 存在于不同的分子中。 分子内氢键起着重要的生物学作用,因为它们决定了例如聚合物蛋白质分子的螺旋结构。 在蛋白质中,这些是氨基酸残基之间的 N-H ... O 键。 同样重要的是分子间氢键。 在它们的帮助下,核酸链连接起来,形成双螺旋结构。 核酸碱基之间有两种类型的键 - NHN 和 N-H-O。 分子热运动的平均动能约为3/2RT。 在 37°C (310°K) 的人体温度下,这约为 4 kJ/mol。 氢键的强度在 10-40 kJ/mol 范围内,因此它们的强度足以承受周围分子的不断冲击,并确保聚合物生物结构形状的恒定性。 同时,在活性分子的撞击下,氢键会周期性地断裂,然后再恢复,保证了各种生命过程的流动。 所考虑的例子清楚地说明了 MO LCAO 方法比 VS 方法更广泛的应用。 然而,VS 方法可以成功地用于预测许多物质的性质和结构,包括复杂的化合物。 32. 环境和人体中的微量元素 人体所含的化学元素有多种分类。 因此,V. I. Vernadsky 根据生物体内的平均含量(质量分数 w,%),按照十天制对元素进行了划分。 按照这种分类,生物体内所含的元素分为三大类:宏观、微量和超微量元素。 宏量营养素 这些是body中含量高于10的元素2%。 这些包括氧、碳、氢、氮、磷、硫、钙、镁、钠和氯。 微量元素 这些是正文中内容在 10 范围内的元素3 到105%。 这些包括碘、铜、砷、氟、溴、锶、钡、钴。 超微量元素 这些是 body 中内容低于 10 的元素5%。 这些包括汞、金、铀、钍、镭等。 目前,超微量元素与微量元素合二为一。 这种分类只反映了生物体内元素的含量,并不表明这种或那种元素的生物学作用和生理意义。 V. V. Kovalsky 根据它们对生命的重要性,将化学元素分为三组。 重要的(不可替代的)元素 它们不断地包含在人体中,是酶、激素和维生素的一部分:H、O、Ca、N、K、P、Na、S、Mg、d、C、I、Mn、Cu、Co、Fe、 Zn、Mo、V。它们的缺乏会破坏正常的人类生活。 杂质元素 这些元素在动物和人类体内不断发现:Ga、Sb、Sr、Br、F、B、Be、Li、Si、Sn、Cs、Al、 Ba、Ge、As、Rb、Pb、Ra、Bi、Cd、Cr、Ni、Ti、Ag、Th、Hg、U、Se。 它们的生物学作用鲜为人知或未知。 杂质元素 Sc、Tl、In、La、Pr、Sm、W、Re、Tb 等。存在于人类和动物中。 有关数量和生物学作用的数据尚未明确。 各种细胞和生物的构造和生命活动所必需的元素称为生物元素。 由于难以确定极低浓度的微量元素并确定其生物学功能,因此仍然无法准确列出所有生物元素。 对于 24 种元素,生物源性得到了可靠的确定。 这些是第一组的元素和第二组的一些元素(根据 Kowalski 的说法)。 33. 人体最重要的生物元素的地形 人体器官本身对各种化学元素的集中程度不同,即微观元素和宏观元素在不同器官和组织之间分布不均。 大多数微量元素在肝脏、骨骼和肌肉组织中积累。 这些组织是许多微量元素的主要仓库(仓库)。 元素可能对某些器官表现出特定的亲和力,并以高浓度包含在其中。 众所周知,锌集中在胰腺中,碘集中在甲状腺中,氟集中在牙釉质中,铝、砷、钒集中在头发和指甲中,镉、汞、钼集中在肾脏中,锡集中在肾脏中肠组织、锶 - 在前列腺、骨组织中、钡 - 在眼睛的有色视网膜中、溴、锰、铬 - 在脑垂体中等。 在生物体中,微量元素可以处于结合状态并以游离离子形式存在。 已知脑组织中的硅、铝、铜和钛与蛋白质呈络合物形式,而锰则呈离子形式。 氢和氧是常量营养素。 它们是水的一部分,成人体内平均含有约 65% 的水。 水在人体器官、组织和生物体液中分布不均。 因此,在胃液、唾液、血浆、淋巴液中,水占 89,5 至 90%,在尿液、大脑灰质、肾脏中 - 80%,在大脑、肝脏、皮肤、脊髓的白质中,肌肉、肺、心脏 - 70-80%。 最少 - 40% 的水 - 包含在骨骼中。 常量营养素——碳、氢、氧、氮、硫、磷——是蛋白质、核酸和身体其他生物活性化合物的一部分。 蛋白质中的碳含量为 51-55%,氧 - 22-24%,氮 - 15-18%,氢 - 6,5-7%,硫 - 0,3-2,5%,磷 - 约 0,5%。 碳、氢和氧也是碳水化合物的一部分,其在动物组织中的含量很低——大约2%。 这些元素是脂类(脂肪)的一部分。 此外,磷脂的组成包括磷酸基团形式的磷。 在最大程度上,脂质集中在大脑 (12%),然后是肝脏 (5%)、乳汁 (2-3%) 和血清 (0,6%)。 然而,磷的主要部分(600 克)存在于骨组织中。 这是人体内所有磷质量的 85%。 磷也集中在牙齿的硬组织中,其中它与钙、氯、氟以羟基、氯、通式 Ca 的氟磷灰石形式存在5 (PO4)3X,其中 X = OH、CI、F。 钙主要集中在骨骼以及牙齿组织中。 钠和氯主要存在于细胞外液中,而钾和镁则存在于细胞内液中。 以氟化物的形式,钠和钾是骨骼和牙齿组织的一部分。 镁作为磷酸镁3 (PO4)2 包含在牙齿的硬组织中。 荷尔蒙参与维持体内一定含量的大量元素和微量元素。 34. 化学元素在体内的生物学作用 化学元素在人体中的生物学作用是极其多样的。 宏量营养素的主要功能是构建组织、维持恒定的渗透压、离子和酸碱成分。 作为络合剂或活化剂的酶、激素、维生素和生物活性物质的一部分,微量元素参与新陈代谢、繁殖过程、组织呼吸和有毒物质的中和。 微量元素积极影响血管和组织的造血、氧化、还原、通透性过程。 常量元素和微量元素——钙、磷、氟、碘、铝、硅——决定骨骼和牙齿组织的形成。 许多与各种微量元素缺乏或过度积累有关的疾病已经得到确认。 氟缺乏导致龋齿,碘缺乏导致地方性甲状腺肿,钼过量导致地方性痛风。 这种模式与以下事实有关:人体中生物元素的最佳浓度保持平衡 - 化学稳态。 由于元素缺乏或过量而破坏这种平衡会导致各种疾病。 除了构成碳水化合物、脂肪、蛋白质和核酸的六大主要常量营养素 - 有机物(碳、氢、氮、氧、硫和磷)外,无机常量营养素 - 钙、氯、镁、钾、钠 - 和微量元素- 铜、氟、碘、铁、钼、锌,还有可能(已证明对动物有益) - 硒、砷、铬、镍、硅、锡、钒。 人体微量元素含量和比例的分析也用于法医检验。 例如,在酒精中毒的情况下,在乙醇的影响下,肝脏中的钙含量增加,钠和钾变少。 与此同时,在心脏和肾脏中,钙含量反而会降低。 饮食中缺乏铁、铜、氟、锌、碘、钙、磷、镁等元素会对人类健康造成严重后果。 然而,必须记住,不仅缺乏,而且过量的生物元素对身体有害,因为这会破坏化学稳态。 含量微不足道的矿物质成分在较高浓度下会变得有毒。 许多元素(银、汞、铅、镉等)被认为是有毒的,因为它们进入人体,即使是微量的,也会导致严重的病理现象。 各种元素及其化合物被广泛用作药物。 因此,研究化学元素的生物学作用,阐明这些元素与其他生物活性物质(酶、激素、维生素)的交换之间的关系,有助于创造新药和开发最佳剂量方案治疗和预防目的。 35. S元素及其化合物 水是地球上最重要和分布最广的氢化合物之一。 水域几乎占地球表面的 75%。 成人体内平均含有 65-67% 的水,胎儿(4 个月) - 94%,新生儿 - 74%。 体内的所有化学反应只发生在水生环境中。 没有水的生活是不可能的。 蒸馏水是药典制剂。 在医疗实践中,使用了另一种氢化合物——过氧化氢 H2 02。 这种化合物是新陈代谢的重要副产品。 双氧水是一种无色透明液体。 与皮肤和黏膜接触会导致灼伤。 分子 H2О2 极性。 氧原子上孤电子对的存在使得过氧化氢与配体 - 电子受体形成供体 - 受体键成为可能。 H中氧的氧化态2О2 等于 1,即它具有介于水中氧 (2) 和元素氧 O 的氧化态之间的中间值2 . 由此得出,过氧化氢既可以表现出氧化剂的性质,也可以表现出还原剂的性质(氧化还原二元性)。 然而,从标准的氧化还原半反应电位来看,过氧化氢更具有氧化特性。 纯过氧化氢在热力学上不稳定,静置时会爆炸性地分解成水和氧气,放出大量热量。 双氧水的水溶液较稳定,在阴凉处可长期保存。 过氧化氢通常以 30% 水溶液 - perhydrol 的形式出售。 在重金属盐的存在下,过氧化氢分解的协同过程显着加速。 过氧化氢的金属离子催化分解可导致自由基的形成,其中最重要的是氢氧根和氢过氧化物。 毒性是由于以下事实2О2 和O-2 与细胞膜的脂质层相互作用并破坏它们。 在医疗实践中,过氧化氢主要用作外用杀菌剂。 动作 H2О2 基于过氧化氢的氧化能力及其还原产物水的无害性。 在治疗伤口时,释放的氧气具有双重作用: 1)具有抗菌、除臭、脱色作用,杀灭微生物体; 2) 形成泡沫,有助于组织腐烂颗粒转变为悬浮状态并清洁伤口。 作为药典制剂,使用3%过氧化氢水溶液,6%过氧化氢溶液用于漂白头发。 以 30% 溶液的形式,过氧化氢用于治疗扁平苔藓的疣状形式并去除年轻的疣。 36. IA族s元素(锂、铷、铯、钫)的生物学作用 根据在人体内的含量,钠(0,08%)和钾(0,23%)为大量营养素,其余碱金属为锂(104%), 铷 (105%), 铯 (104%) - 微量元素。 锂 人体内锂的含量约为70毫克(10毫摩尔) - 104%。 高等动物体内的锂化合物集中在肝脏、肾脏、脾脏、肺脏、血液和乳汁中。 在人体肌肉中发现了最大量的锂。 锂作为微量元素的生物学作用尚未完全阐明。 已经证明,在细胞膜的水平上,锂离子(在足够的浓度下)在渗透到细胞中时会与钠离子竞争。 显然,锂离子取代电池中的钠离子与锂化合物的更大共价相关,因此它们更好地溶解在磷脂中。 已经确定一些锂化合物对躁狂抑郁症患者有积极作用。 从胃肠道吸收,锂离子在血液中积累。 当锂离子浓度达到0,6 mmol/l及以上时,情绪紧张度降低,躁狂觉醒减弱。 同时,必须严格控制血浆中锂离子的含量。 在锂离子浓度超过 1,6 mmol/l 的情况下,可能会出现负面现象。 铷和铯 根据人体内铷的含量(105%) 和铯 (104%) 属于微量元素。 它们不断地包含在体内,但它们的生物学作用尚未阐明。 作为钾的完全类似物,铷也积聚在细胞内液中,可以在各种过程中替代等量的钾。 放射性同位素 13r铯和 87Rb 用于恶性肿瘤的放射治疗,以及钾代谢的研究。 由于它们的快速分解,它们甚至可以被引入体内,而不必担心长期有害影响。 钫 这是一种通过人工手段获得的放射性化学元素。 有证据表明,钫可以在肿瘤发展的最早阶段选择性地积聚在肿瘤中。 这些观察结果可能有助于癌症的诊断。 因此,在IA族元素中,Li、Rb、Cs具有生理活性,而Na和K则具有生命力。 Li和Na的物理化学性质的接近,由于它们原子电子结构的相似性,也表现在阳离子的生物作用上(在细胞外液中的积累,互换性)。 大周期元素阳离子生物作用的相似性质 - K+, 铷+, CS+ (在细胞内液中的积累,互换性)也是由于它们的电子结构和物理化学性质的相似性。 这是在锂盐和铷盐中毒的情况下使用钠和钾制剂的基础。 37. IA族s元素(钠、钾)的生物学作用 体重70公斤的人体中的钠含量约为60克(2610毫摩尔)- 0,08%。 其中,44% 的钠存在于细胞外液中,9% 存在于细胞内液中。 其余的钠在骨组织中,这是体内钠离子沉积的地方。 骨组织中约有 40% 的钠参与代谢过程,因此,骨骼要么是 Na 离子的供体,要么是 Na 离子的受体,这有助于维持细胞外液中 Na 离子浓度恒定。 钠是主要的细胞外离子。 在人体内,钠以其可溶性盐的形式存在,主要是氯化物、磷酸盐和碳酸氢盐。 钠分布于全身:存在于血清、脑脊髓液、眼液、消化液、胆汁、肾脏、皮肤、骨组织、肺和脑中。 Na离子在确保人体内部环境的恒定性方面发挥着重要作用,参与维持生物流体的恒定渗透压(渗透稳态)。 钠离子参与水代谢的调节并影响酶的功能。 钠离子与钾、镁、钙、氯离子一起参与神经冲动的传递,维持肌肉细胞的正常兴奋性。 当体内钠含量发生变化时,会出现神经、心血管等系统、平滑肌和骨骼肌的功能障碍。 氯化钠 NaCl 是胃液中盐酸的主要来源。 钠主要以食盐的形式进入人体。 人体对钠的真正每日需求量是 1 克,尽管这种元素的平均摄入量达到 4-7 克。持续过量摄入 NaCl 会导致高血压。 在碱对微生物细胞的影响下,细胞蛋白质发生沉淀,结果导致微生物死亡。 硫酸钠(芒硝)Na2SO4 × 10小时2O用作泻药。 四硼酸钠2B4О7 × 10小时2O在外部用作冲洗、冲洗、润滑的防腐剂。 10% 溶液形式的氢氧化钠是骨科实践中使用的硅灵的一部分,用于铸造由钴铬合金制造的铸造假体的耐火模型。 体重 70 公斤的人体中钾的含量约为 160 克(4090 毫摩尔)- 0,23%。 钾是细胞内主要的阳离子,占细胞内活性阳离子总数的2/3。 在体内所含的钾总量中,98% 位于细胞内,只有约 2% 位于细胞外液中。 钾分布在全身。 它的地形图:肝脏、肾脏、心脏、骨组织、肌肉、血液、大脑等。K离子在生理过程中起着重要作用——肌肉收缩、心脏的正常功能、神经冲动的传导、代谢反应。 K 离子是位于细胞内的酶的重要激活剂。 38. IIA 组 s 元素的生物学作用。 它们在医学中的用途(铍、镁、钙) 铍存在于植物和动物有机体中。 铍在生物体内的含量为107%,即为杂质超微量元素。 铍的生物学作用尚未得到足够的研究。 铍化合物是有毒的,会引起许多疾病(铍佝偻病、铍病等)。 铍的挥发性化合物特别有毒。 Be2 + 对生理过程的负面影响可以通过其化学性质来解释。 镁在形式上是一种常量营养素。 其在体内的总含量为0,027%(约20克)。 镁在人体内的分布情况如下:镁最大程度地集中在牙本质和牙釉质、骨组织中。 它还积聚在胰腺、骨骼肌、肾脏、大脑、肝脏和心脏中。 成年人每天对镁的需求量约为 0,7 克。Mg 离子与 K 离子一样,是一种细胞内阳离子。 在身体的生物体液和组织中,镁以水离子的形式和蛋白质结合状态的含量 < 102%,即本质上是一种微量元素。 细胞内镁离子的浓度大约是细胞外液的 2,5-3 倍。 镁离子在人体中起着重要的生物学作用。 由于 Mg 的离子半径较小,电离能较高2+ 形成比 Ca 离子更强的键,因此是酶促过程更活跃的催化剂。 作为各种酶系统的一部分,镁离子是它们不可或缺的成分和激活剂(羧肽酶、胆碱酯酶等酶对镁离子具有特异性)。 与许多酶促反应相关的 ATP 水解,其结果是形成氢磷酸化 HPO2 并释放大量能量,发生在过量的 Mg 下2+. 钙是一种常量营养素。 它在体内的总含量为1,4%。 钙存在于人体的每个细胞中。 大部分钙存在于骨骼和牙齿组织中。 平均而言,一个成年人每天应该摄入 1 克钙,虽然对钙的需求仅为 0,5 克。与食物一起服用的钙只有 50% 被肠道吸收。 相对较差的吸收是由于在胃肠道中形成微溶性磷酸钙 Ca3(PO4)2 和脂肪酸的钙盐。 在体内,钙离子的浓度受激素的调节。 在成年人的骨骼和牙齿中,约有 1 公斤的钙以不溶性结晶矿物的形式存在 - 羟基磷灰石 Ca10(RO4)6(OH)2 ,其形成发生在 Ca 离子与磷酸盐的相互作用过程中。 在血液和淋巴液中,钙以电离和非电离状态存在 - 在与蛋白质、碳水化合物等的化合物中。血液凝固机制由多个阶段组成,具体取决于电离 Ca 的存在。 Ca 离子参与神经冲动的传递、肌肉收缩、心肌的调节。 细胞内外Ca离子浓度分别为106 和 (2,25-2,8) 103 摩尔/升。 由于钙实际上不在细胞内使用,因此它在体内充当建筑材料 - 在骨骼和牙齿中。 骨骼是人体钙的主要储存库。 39. VIB 组 d 元素的生物学作用。 它们在医学上的用途 铬存在于植物和动物有机体中。 成年人的身体中大约含有 6 克铬(0,1%)。 铬金属无毒,而 Cr(III) 和 Cr(VI) 化合物对健康有害。 它们会引起皮肤刺激,从而导致皮炎。 有一种假设认为铬 (VI) 的衍生物具有致癌特性。 0,25-0,3克重铬酸钾致人死亡。 铬 (VI) 化合物用作杀菌剂(酸洗剂、真菌 - “蘑菇”、caldere - “杀死”)。 铬 (III) 化合物对植物生长具有有益作用。 钼属于“生命金属”,是最重要的生物元素之一。 20-25 年前,F. Krin 和 L. Oril 注意到了它的特殊地位。 这些科学家提出了地球上生命的出现不是进化产生的观点,而是由一个未知的文明从钼星带来的,那里的生命早在我们之前就已经存在。 在生化过程中,钼参与了 VI 和 VI 的氧化态。 在这些状态下,它会产生稳定的氧代形式。 钼形成稳定的氧代络合物,因此显然它是确保氧代基团转移的酶的一部分。 Mo (VI) 在血液中占优势; 如果配体是氧,则形成稳定的同多钼化合物。 食物中钼含量过高会破坏钙代谢2+ 和反渗透4 ,导致骨强度下降 - 骨质疏松症。 可能会结合到磷钼复合物中。 这种复合物可以被认为是杂多钼酸的酸残基。 与钙一起,这些残留物形成不溶性晶体。 这些晶体可能会引发尿酸盐沉积并引起痛风。 痛风使关节变形,证明其字面翻译是正确的 - “足部陷阱”。 除氧络合物外,钼还形成卤化物 (Hal)、硫氰酸盐 (NCS) 和氰化物 (CN) 络合物。 钼是各种酶的成分。 在人体中,这些包括醛羟化酶、黄嘌呤脱氢酶和黄嘌呤氧化酶。 黄嘌呤氧化酶 (COX) 的分子量为 250 a.u. e. m. 这是哺乳动物的含钼酶。 它可以催化黄嘌呤和其他嘌呤以及醛的氧化。 次黄嘌呤和黄嘌呤向尿酸的转化由黄嘌呤氧化酶催化。 假设在催化过程中,钼与黄嘌呤的氮和氧形成键。 钼是植物中最重要的微量元素,因为其参与的生物活性物质可提供温和的固氮作用:它们将钼转化为氨或含氮产品。 与其他工业上重要的金属相比,钼具有低毒性。 钼与食物的摄入量为 0,1 - 0,3 毫克/天,但尚未确定所需的每日摄入量。 钼缺乏会导致组织中黄嘌呤氧化酶活性降低。 钼含量过高会导致骨质疏松症。 钨是一种微量元素。 它在体内的作用尚不清楚。 钨的阴离子形式很容易被胃肠道吸收。 金属钨及其阳离子形式不会被人体吸收。 没有关于哺乳动物中钨稳态的信息。 40. 锰化合物的生物作用。 它们在医学上的用途 在第VIIB族元素中,只有锰是一种生物元素,是生物体正常过程所必需的十种“生命金属”之一。 成人体内含有 12 毫克。 锰集中在骨骼中 (43%),其余集中在软组织中,包括大脑。 在体内,锰与蛋白质、核酸、ATP、ADP、单个氨基酸形成金属络合物。 含锰金属酶精氨酸酶、胆碱酯酶、磷酸葡萄糖变位酶、丙酮酸羧化酶。 氨 - 哺乳动物体内氨基酸转化的有毒产物 - 的结合是通过氨基酸精氨酸进行的。 精氨酸酶是一种催化肝脏中精氨酸水解的酶。 结果,精氨酸被分解成尿素和环状氨基酸鸟氨酸。 尿素是一种无毒的水溶性物质。 它由血流携带至肾脏并随尿液排出体外。 锰的原子半径为 128 pm。 这解释了锰与 ATP 结合可以取代镁(原子半径 160 pm),显着影响体内能量转移的事实。 Mg 和 Mn 离子还可以激活酶 - 核酸酶。 这些酶催化十二指肠中 DNA 和 RNA 核酸的水解。 结果,这些生物聚合物被分解成单体单元——核苷酸。 特别是,这种核酸酶是脱氧核糖核酸酶,它仅在 Mg 存在的情况下才催化 DNA 水解2+ 或锰2+. 锰也可以是体内无机化合物的一部分。 例如,这是一种难溶性焦磷酸锰镁 MnMgP2O7. 这种盐的晶体位于囊泡膜的内表面。 几乎相同的锰和铁的原子半径值解释了锰在红细胞卟啉复合物中取代铁的能力。 出于同样的原因,锰还可以取代锌依赖性酶中的锌,从而改变它们的催化性能。 高锰酸钾 KMnO4 - 最著名的用于医药的锰化合物。 使用含有 KMnO 的水溶液4 0,01-5%。 作为止血剂,使用5%的溶液。 高锰酸钾溶液具有防腐性能,这是由其高氧化能力决定的。 在其他锰化合物中,应注意硫酸锰 (II) 和氯化锰 (II),它们用于治疗贫血。 没有关于活生物体中存在锝的数据。 然而,具有双膦酸盐的锝化合物用于放射性同位素诊断方法。 41.铁化合物的生物学作用。 血红蛋白 铁是在动植物组织中发现的一种生物元素。 成人体内铁的总质量约为 5 g,即 0,007%。 金属铁是低毒的,大量的Fe(II)、Fe(III)和Fe(VI)化合物对健康有害。 肌红蛋白、细胞色素、过氧化氢酶提供细胞呼吸作用。 所有这些蛋白质都由它们自己的蛋白质部分和与之相关的活性中心组成。 活性中心是大环络合物——血红素。 化合物卟啉充当大环配体。 供体氮原子位于正方形的角落,正方形的中心是 Fe 离子。 通常,络合物具有八面体构型。 通过氨基酸(组氨酸)氮原子的第五个轨道用于将血红素与蛋白质结合。 血红蛋白由形成单个大分子聚集体的 4 个蛋白质分子(亚基)组成。 每个亚基在结构上与肌红蛋白分子相似。 因此,血红蛋白可以同时结合四个 O2 和肌红蛋白 - 1。 组织中还有几种不含血红素铁的蛋白质复合物。 这些是,例如,酶 - 氧化酶,以及蛋白质 - 铁的储存(仓库)和载体。 过量的铁通过转铁蛋白在血液中运输,并以铁蛋白的形式积聚在各种组织器官中,尤其是在肝、脾和骨髓中。 铁蛋白由 24 个蛋白质分子(亚基)组成,形成一个直径为 12-14 nm 的球体。 每个亚基包含一个直径为 7 nm 的空腔,其中包含多达 4500 个铁原子。 因此,每个铁蛋白聚集体可以储存大约 100 个铁原子,提供许多涉及该元素的代谢反应。 根据化学平衡定律,不难理解血红蛋白作为氧气载体从肺部到组织的功能。 无氧血红蛋白(脱氧血红蛋白)是一种弱酸,其化学式可以表示为HHb+. 氧的加入伴随着质子的消除,并形成氧合血红蛋白 HbO。2 . 在这种情况下,有一个平衡: 血红蛋白+ + O.2 → 血红蛋白2 + N.+. 当缺氧静脉血进入肺部时,氧气的分压很高(高达 20 kPa),其溶解度根据亨利定律增加。 根据 Le Chatelier 原理,这导致平衡向右移动并形成氧合血红蛋白。 另一个平衡向右移动的原因是肺部的 pH 值增加(高达 7,5)。 结果,在肺中,脱氧血红蛋白几乎完全(高达 97%)被氧气饱和并转化为氧合血红蛋白。 在穿透外周组织的毛细血管中,氧分压降至5 kPa,pH值降至7,2。 结果,平衡向左移动。 在从外周流出的血液中,血红蛋白仅被氧饱和了 65%。 42. 铁化合物的生物学作用。 一氧化碳。 含血红素蛋白的金属络合物特性在CO(一氧化碳)和MCN(氰化物-氢氰酸盐)等有毒物质的作用下表现出来。 从生理学的角度来看,最重要的是含铁蛋白质:血红蛋白、肌红蛋白、细胞色素、过氧化物酶、过氧化氢酶。 血红蛋白 - 红细胞的主要成分,提供外部呼吸,是从肺部到组织的氧气载体。 铁铁和钴钴是生物体必需的微量元素。 一氧化碳CO是燃料不完全燃烧的产物之一。 在锅炉、内燃机和吸烟过程中会排放大量这种气体。 当一氧化碳与肺中的空气同时吸入氧合血红蛋白 HbO时2 形成金属络合物-羰基血红蛋白HbCO。 HbCO的稳定常数约为HbO的200倍2 . 因此,即使是少量的 CO 也会“拦截”很大比例的脱氧血红蛋白,结果导致器官的氧气供应减少。 有缺氧的迹象——缺氧。 神经组织是最先受到影响的。 为了解毒(消除毒性作用)一氧化碳,在许多情况下,停止供应并增加氧气通风就足够了 - 将受害者带到新鲜空气中。 在这种情况下,勒夏特列原理再次起作用——平衡向氧合血红蛋白的形成方向移动。 在高浓度下,一氧化碳会阻断细胞呼吸中含有血红素的蛋白质,因此很难避免致命的后果。 氰化物的作用机制相似,但毒性高于一氧化碳。 即使是非常少量的这些物质进入血液也会导致呼吸停止和死亡。 氰化物的高毒性是由高强度的 Fe-CN-键来解释的,这决定了氰化物血红蛋白的稳定性。 氧气呼吸导致过氧化氢H的形成2O2 . 这种物质具有很强的氧化能力。 当它与细胞的生物有机化合物相互作用时,会形成自由基 - 具有不饱和价的非常活泼的分子颗粒,并引发过氧化物氧化。 在自由基的影响下,细胞最重要的成分——细胞膜和 DNA——被破坏。 在生物进化过程中,大自然发展出一种特殊的蛋白质——过氧化氢酶,它能破坏过氧化氢。 这限制了这种物质的过量积累,并防止了细胞的破坏。 过氧化氢酶(CatFe2+ ) 可以表示为两个连续反应的催化循环: 咖啡2+ + N.2O2 - 猫铁2+ × 高2O2 , 咖啡2+ × 高2O2 + N.2O2 → 猫铁2+ +2Н2O2 + O.2 . 结果,2个过氧化氢分子被破坏,CatFe2+生物催化剂分子被释放出来,可以进入下一个催化循环。 这个过程非常快。 在一秒钟内,一个过氧化氢酶分子可以进行多达 1 次循环。 43. 铁钴化合物的生物学作用 由于体内缺乏铁,可能会发展一种疾病 - 缺铁性贫血(贫血)。 组织缺氧与血红蛋白合成缺乏铁有关。 结果,输送到外周器官的氧气减少,因此,细胞呼吸水平降低,新陈代谢减慢。 引入氯化铁 (II) 或硫酸铁 (II) 作为药物可降低疾病的严重程度。 出于同样的目的,使用了金属铁的细粉(还原铁,每剂最多 1 克),它很容易溶于胃液的盐酸中。 因此,该药的作用类似于氯化铁(II)。 然而,铁与糖、烟酰胺和其他有机物质的生物无机复合物的药物更有效。 这种复合物很好地吸收到血液中,这是它们药理效力的原因。 有趣的是,从古至今,人们都用所谓的铁酒来治疗缺铁性贫血——一种将葡萄酒浸泡在铁屑上得到的饮料。 显然,铁溶解在葡萄酒(酸性环境)中并与天然有机物质形成络合物,并大量包含在其中。 很明显,古代饮料的作用机制与现代药物大致相同。 与铁一样,钴也是最重要的生物元素之一。 成人体内钴的总质量约为 1,2 毫克,不足 10%。 大约 100 毫克的这种物质是氰钴胺素(脂溶性维生素 B12 ) 及其类似物。 这种物质与血红素一样,是一种大环络合物。 四齿化合物卟啉充当大环配体。 R是复杂的有机取代基。 在氰钴胺的类似物中,各种有机取代基代替 CN 阴离子起作用。 维生素B最重要的作用12 参与红细胞的发育和形成(红细胞生成)。 维生素B缺乏12 (每天摄入少于 3 微克)会导致严重的疾病 - 恶性贫血(贫血)。 已经确定氰钴胺素的类似物是激活剂 - 参与红细胞生成的各种酶的辅助因子。 辅因子的缺乏表现为血红蛋白和红细胞的缺乏。 动植物不能合成维生素B12. 它仅由某些类型的细菌产生。 这些细菌存在于人体胃肠道中。 他们合成足够的维生素B12. 恶性贫血与这种维生素在血液中的吸收受损有关。 因此,吃药是无效的。 向血液中注射维生素(100-200 mcg 2 天)可显着改善恶性贫血患者的病情。 44. IB-组d-元素的作用。 它们的化合物在医学中的用途 铜 Cu 是生物体必需的微量元素。 银Ag和金Au是微量杂质元素。 它们的化合物用于医学。 铜是一种存在于动植物组织中的生物元素。 成人体内铜的总质量约为100毫克,约为0,0001%。 该数量的大约 30% 存在于肌肉中。 肝脏和大脑也富含铜。 金属铜及其化合物有毒。 从生理学的角度来看,最重要的是含铜蛋白质——细胞色素氧化酶和超氧化物歧化酶。 细胞色素氧化酶是位于线粒体膜中的呼吸链的成分之一。 通过在呼吸链末端将氧气还原为水来提供细胞呼吸。 人体每天需要 2,5-5,0 毫克的铜。 由于体内缺乏铜,会发展出一种疾病——缺铜性贫血。 铜对于铁的吸收是必需的,特别是在细胞色素氧化酶的合成中,它同时含有铁和铜。 缺铜会破坏结缔组织和血管的正常发育。 中毒通常与意外过量服用杀虫剂、吸入金属粉末、摄入铜盐溶液有关。 储存在铜容器中的饮料没有壁保护涂层是非常危险的。 作为外剂,使用0,25%的硫酸铜CuSO水溶液。4 伴有黏膜炎症和结膜炎。 小剂量的这种药物可以与食物一起服用,以增加贫血的红细胞生成。 银和金 在成年人体内,发现了大约 1 毫克的银,即大约 10%(百万分之一)和高达 1 毫克的金,即大约 10%(百万分之十)。 可溶性银盐的防腐性能自古以来就为人所知。 很久以来,祭司们就知道,水(“圣洁”)储存在银器中时,不会长期变质,也就是说,它不会受到微生物的污染。 目前,水手们在长途航行中使用这种“银”水的特性。 当摄入 7 g AgNO 时,在成人中观察到强烈的毒性表现。3. 在医学上,长期使用结晶硝酸银AgNO03(青金石)及其水溶液等药物。 胶体金属银制剂 protargol (8% Ag) 和 collgol (70% Ag) 早已为人所知,它们是具有金属光泽的细粉末。 这种粉末的每个颗粒都是尺寸小于 1 μm 的还原金属银晶体,具有白蛋白 (protargol) 或胶原蛋白 (collargol) 的蛋白质涂层。 蛋白质外壳保护银晶体不粘在一起,并确保它们过渡到水性介质中(溶解)。 银制剂用作抗炎剂、防腐剂和收敛剂。 金制剂也用作有效的抗炎药。 最著名的是含有 30% 贵金属的 krizanol 和胶体金。 45. IIB 组 d 元素的生物学作用。 它们的化合物在医学中的用途 锌Zn、镉Cd、汞Hg是微量元素。 成人体内含有 1,8 克锌、50 毫克镉、13 毫克汞。 镉和汞是杂质元素。 大约 70% 的汞集中在脂肪和肌肉组织中。 镉在肾脏中占 30%,其余在肝脏、肺和胰腺中。 锌是所有植物和动物的必需元素。 在成年人体内,大部分锌存在于肌肉(65%)和骨骼(20%)中。 其余的量落在血浆、肝脏、红细胞上。 前列腺中锌的最高浓度。 锌不表现出可变价态。 因此,显然,它的生物复合物参与了许多在没有电子转移的情况下发生的水解生化反应。 锌离子是催化酯类和蛋白质水解的 40 多种金属酶的一部分。 研究最多的一种是锌的生物无机复合物——碳酸酐酶(Mg = 30),由大约 000 个氨基酸残基组成。 锌不是二肽酶的一部分 - 催化二肽(由 2 个氨基酸组成的物质)水解的酶。 锌与胰岛素形成生物无机复合物,胰岛素是一种调节血糖的激素。 人类对锌的需求完全可以通过食品来满足:肉类、奶制品、鸡蛋。 由于植物缺锌,蛋白质和碳水化合物的代谢受到干扰,叶绿素和维生素的合成受到抑制。 使用含锌肥料可以消除锌缺乏症。 IIB 族化合物的毒性从锌到汞递增。 水溶性化合物会刺激皮肤,如果摄入会导致中毒。 金属本身也有毒——当吸入锌蒸气(生产锌的空气)时,会出现“金属”热。 中世纪的汞蒸气中毒被称为“疯帽匠病”。 食物中的汞含量(在海洋中,如在日本)会导致 minomata 病。 汞毒性与红细胞凝集(粘在一起)、酶抑制有关。 例如,升华导致红细胞大小变化、渗透脆性和变形能力降低,这是红细胞通过毛细血管运动所必需的。 镉的毒性与其对核酸的亲和力有关。 由于它附着在 DNA 上,它的功能被破坏了。 慢性镉和汞毒性会损害骨矿化。 有毒元素可以代替钙。 由于骨组织的结晶成分参数的扭曲,这导致形成具有不完美结构的磷灰石。 结果,骨强度降低。 46.IIB组化合物的毒性特性(Zn、Cd、Hg) 化合物 Zn、Cd、Hg 可导致蛋白质代谢紊乱,表现为通过肾脏释放血浆蛋白(在蛋白尿中)。 IIB 族化合物对身体的毒性作用也是由于这些金属离子与蛋白质、酶和氨基酸的巯基 SH 基团相互作用而引起的。 当金属离子与 SH 基团相互作用时,会形成弱解离且通常不溶的化合物。 因此,阻断巯基会抑制酶活性和蛋白质折叠。 二价金属离子同时阻断两个 SH 基团。 在这种类型的反应中,金属离子充当受体,而硫充当电子供体。 对汞中的 SH 基团最显着的化学亲和力。 显然,这是因为汞的络合性更高,与硫形成更强的键合。 SH 基团是 100 多种酶的一部分,由于这些基团的阻断,它们的活性会受到抑制。 因此,了解金属中毒机体的阻断机制和治疗方法的重要性不言而喻。 众所周知,元素的毒性取决于它们进入人体的化学形式。 毒性最强的形式是那些溶解在脂质中并容易穿过膜进入细胞的形式。 文献描述了日本的一起大规模汞中毒案例。 无机汞化合物在微生物酶的作用下转化为甲基汞。 甲基汞在鱼类体内积累,然后随食物进入人体。 逐渐浓缩的甲基汞会对身体造成不可逆转的破坏和死亡。 锌和汞化合物在医学中的使用是基于它们的收敛、烧灼和防腐作用。 作为滴眼剂,使用0,25%的硫酸锌ZnSO水溶液。4. 在牙科中,氯化锌用于烧灼乳头状瘤,治疗发炎的粘膜。 也使用氧化锌ZnO。 氯化汞(II)(氯化汞)毒性很大,其水溶液以高稀释度(1:1000)用于消毒。 对于皮肤和性传播疾病的治疗,使用含有氧化汞 (II) HgO 和硫化汞 (II) HgS 的软膏。 氯化汞(I)(甘汞)难溶于水,因此具有轻微毒性。 这种盐在兽医学中用作泻药。 汞在正常情况下是一种液态金属,可以溶解其他金属。 在这种情况下,会形成硬质合金 - 汞合金。 在牙科领域,银汞合金和镉汞合金长期以来一直用于补牙。 它们具有化学惰性,加热时容易软化,因此易于成型。 紫外线光源 - 用于医疗目的的汞石英灯 - 含有气态汞(蒸气)。 当在医院房间里用这些灯发出的光照射时,空气中的微生物就会被破坏。 在紫外线的帮助下,可以治疗各种皮肤病。 因此,根据功能的性质和对身体的影响,IIB族金属可分为生命元素Zn和有毒杂质元素Cd和Hg。 47. IIIA 组 p 元素的生物学作用。 它们的化合物在医学中的用途 硼是一种杂质微量元素,它在人体内的质量分数为105%。 硼主要集中在肺(0,34 mg)、甲状腺(0,30 mg)、脾(0,26 mg)、肝、脑(0,22 mg)、肾、心肌(0,21 mg)。 硼的生物学效应尚未得到充分研究。 硼已知存在于牙齿和骨骼中,显然是以微溶的硼酸与金属阳离子的盐的形式存在。 过量的硼对人体有害。 有证据表明,过量的硼会抑制淀粉酶、蛋白酶,并降低肾上腺素的活性。 根据人体内的含量(105%),铝属于杂质微量元素。 铝主要集中在血清、肺、肝脏、骨骼、肾脏、指甲、头发中,进入人脑神经鞘的结构。 人类每天摄入的铝量为 47 毫克。 铝影响上皮和结缔组织的发育,骨组织的再生,影响磷的交换。 铝对酶促过程有影响。 体内过量的铝会抑制血红蛋白的合成,因为铝具有相当高的络合能力,会阻断参与造血的酶的活性中心。 有证据表明铝可以催化氨基转移反应。 镓是一种杂质微量元素(人体内的含量为10 - 6-10 - 5%)。 镓在生物体中的生物学作用几乎不清楚。 铊是一种剧毒元素。 T1 离子与 Ag+ 一样倾向于与含硫配体形成强化合物。 因此,它具有很强的毒性,因为它会抑制含硫基团 - SH 的酶的活性。 即使摄入非常少量的 T1+ 化合物,也会导致脱发。 由于半径 K 接近+ 和 T1+ 它们具有相似的特性,并且能够在酶中相互替代。 离子 T1 和 K 是增效剂。 这解释了这样一个事实,即丙酮酸激酶和二醇脱水酶不仅被 K 离子激活,而且还被 T1 离子激活(T1 离子取代了酶催化中心的 K 离子)。 铊和钾的协同作用还表现在,与 K 离子一样,T1 离子在红细胞中积累。 作为 T1 离子中毒的解毒剂,使用含硫配体氨基酸胱氨酸。 总之,应该指出的是,IIIA 族 p 元素的生物学作用尚未得到充分研究。 现在已知硼和镓在植物中与多酚相互作用,多酚是它们发育的抑制剂,降低了后者的毒性。 铝在上皮和结缔组织的构建中的作用毋庸置疑,此外,它还作为活化剂和抑制剂参与酶促过程。 T1 离子具有抑制许多含硫酶的能力。 IIIA族元素的生物活性主要与它们与含氧配体和不溶性磷酸盐形成络合物的能力有关。 48. IVA 组 p 元素的生物学作用。 它们的化合物在医学中的用途 按照人体内的含量(21,15%),碳属于常量营养素。 它以蛋白质、脂肪、碳水化合物、维生素、激素的形式存在于所有组织和细胞中。 从生物学的角度来看,碳是排名第一的有机原。 按照人体内的含量(103% ־),硅属于杂质微量元素。 大多数硅存在于肝脏、肾上腺、头发、晶状体中。 由于天然二氧化硅难溶于水,因此它不是通过消化道进入人体,而是通过空气以尘埃 SiO 的形式通过肺部进入人体2. 与硅代谢紊乱,高血压、风湿、溃疡、贫血的发生有关。 在医疗实践中,使用碳化硅 (IV) SiC - 用于研磨填充物和塑料假体的碳化硅。 二氧化硅2 硅酸盐水泥的一部分。 应该注意的是,由煤、二氧化硅和铝颗粒组成的粉尘,当系统地暴露在肺部时,会导致一种疾病——尘肺病。 在煤尘的作用下,是炭疽病,是矿工的一种职业病。 吸入含有 S1O 的粉尘2 ,发生矽肺病,在铝粉的作用下——铝沉着症。 根据人体内的含量(10 - 6-10 - 5%) 锗是一种微量元素。 生物学作用尚未完全阐明。 锗化合物增强骨髓中的造血过程。 还已知锗化合物具有低毒性。 根据人体内的含量(104 %) 锡是指微量元素。 锡通过涂有一层锡的锡罐中保存的酸性食物进入人体。 在酸性环境中,锡溶解并以盐的形式进入血液,表现出毒性作用。 然而,在对大鼠的实验中,发现少量的锡对大鼠的生长有刺激作用。 这让我们有理由假设它对人类的必要性。 毫无疑问,阐明这种微量元素的生物学作用需要进一步研究。 在医疗实践中,使用各种材料,特别是含有锡的填充材料。 因此,锡是用于制造填充物的银汞合金 (28%) 的一部分。 铅及其化合物,尤其是有机化合物,具有剧毒。 先导化合物影响蛋白质合成、细胞能量平衡及其遗传装置。 许多因素都支持变性机制。 已经确定,铅是食物中影响龋齿形成的元素之一。 通过食物、水和大气,一个人每天吸收的铅高达 100 微克。 铅主要以微溶磷酸盐的形式沉积在骨骼中(高达 90%)。 铅在人体内的质量分数为106%־。 每天摄入 0,2-2 毫克的铅被认为对人类是安全的。 在医疗实践中,醋酸铅(洗剂)和氧化铅 (II) PbO(简单铅贴片的一部分)已被用作外用收敛剂防腐剂。 49. VA 族 p 元素的生物学作用。 它们的化合物在医学中的用途(氮、磷) 人体内的氮含量(3,1%)是指常量营养素。 如果我们只考虑身体的干物质质量(不含水),那么细胞中的氮含量为 8-10%。 这种元素是氨基酸、蛋白质、维生素、激素的组成部分。 氮与生物分子中的氢和碳原子形成极性键。 在许多生物无机复合物(金属酶)中,氮原子通过供体-受体机制结合分子的无机和有机部分。 与氧和碳一起,氮形成重要的化合物 - 包含具有碱性性质的氨基和具有酸性性质的羧基 (-COOH) 的氨基酸。 氨基在核酸分子中也起着非常重要的作用。 含氮生物配体——卟啉,如血红蛋白,其生理意义是巨大的。 氮循环发生在生物圈中。 氮循环对农业至关重要。 有必要注意氮的另一个重要的生物学特性 - 它在水中的溶解度几乎与氧气相同。 血液中存在过量的氮可能是导致减压病的原因。 随着潜水员的快速上升,压力急剧下降,氮在血液中的溶解度相应降低(亨利定律),离开血液的元素氮气泡堵塞小血管,导致瘫痪和死亡。 根据在人体内的含量(0,95%),磷属于常量营养素。 磷是一种器官元素,在新陈代谢中起着极其重要的作用。 磷以磷酸盐的形式存在,是细胞内 ATP 的重要组成部分。 它是蛋白质(0,5-0,6%)、核酸、核苷酸和其他生物活性化合物的一部分。 磷是动物和人类骨骼(正磷酸钙、羟基磷灰石)、牙齿(羟基磷灰石、氟磷灰石)的基础。 许多生物合成反应是由于磷酸基团从高能受体转移到低能受体而进行的。 磷酸盐缓冲系统是血液中的主要缓冲系统之一。 生命有机体离不开磷。 磷的重要性在于,糖和脂肪酸在没有事先磷酸化的情况下不能被细胞用作能量来源。 体内磷的交换与钙的交换密切相关。 这可以通过血液中钙含量的增加(拮抗作用)而减少无机磷的量来证实。 人类每天对磷的需求量为 1,3 克。磷在食品中的含量如此之高,以至于其明显缺乏(磷酸盐饥饿)的情况几乎不为人知。 然而,并非食物中所含的所有磷都能被吸收,因为它的吸收取决于许多因素:pH值、食物中钙磷的比例、食物中脂肪酸的存在,但首先取决于维生素的含量D. 许多磷化合物被用作药物。 应该注意的是,含有 C-P 键的有机磷化合物是强神经毒剂,是化学战剂的一部分。 50. VA 族 p 元素(砷、锑、铋)的生物学作用。 它们在医学上的用途 根据人体内的含量,砷属于微量元素。 它集中在肝脏、肾脏、脾脏、肺、骨骼、头发中。 大多数砷存在于脑组织和肌肉中。 砷会在骨骼和头发中积聚,并在几年内无法完全清除。 此功能用于法医检查,以澄清是否存在砷化合物中毒的问题。 生物材料中砷的测定是在一个简单的装置中根据 Marsh 反应进行的:将锌和盐酸添加到生物对象中。 反应过程中释放的氢气将任何砷化合物还原为胂。 如果释放的氢气中含有胂混合物,则当气体混合物加热时,AsH 会分解3 : 2ASH3 = 2As° + 3H2. 在气体释放管的壁上形成了一层黑色闪亮的砷涂层——“砷镜”。 Marsh 反应非常灵敏,可以检测 7-107 g 砷。 在相对较大的剂量下,砷化合物是非常有毒的。 如前所述,砷化合物的毒性作用是由于阻断酶和其他生物活性物质的巯基。 按照在人体内的含量(10%),锑和铋是微量元素。 根据 V. V. Kovalsky 的分类,锑和铋属于在生物体中经常发现的一组微量元素,但其生理生化作用实际上尚不清楚。 锑的生理作用显然与砷相似。 砷 As 和锑 Sb 的离子以及较小程度的铋 Bi 是增效剂。 由此可知,在生物体中砷含量超标的生物地球化学省份,不仅砷含量增加,锑含量也增加。 同时,这两种元素在居民的甲状腺中积累,抑制其功能并引起地方性甲状腺肿。 砷和锑的协同作用与它们与含硫配体形成化合物的能力有关。 铋更倾向于与含有氨基的配体结合。 因此,可溶性铋化合物进入体内会导致酶氨基和羧基多肽酶的抑制。 摄入水溶性锑化合物,例如 stibine SbH3,具有与砷化合物相似的毒性作用。 铋化合物在注射时也是有毒的。 例如,对于狗,致死剂量为 6 mg/kg 体重。 然而,当大多数锑和铋化合物进入消化道时,它们实际上没有毒性作用。 这些化合物的弱毒性是由于消化道中的 Sb (III)、Bi (III) 盐发生水解,形成不被胃肠道壁吸收的难溶性产物。 这是使用锑和铋药物的基础,例如碱式硝酸铋。 51. VIA 组 p 元素的生物学作用。 它们的化合物在医学中的用途 根据人体内的含量(62%),氧气属于常量营养素。 它是不可或缺的,是构成生命系统基础的最重要的元素之一,也就是说,它是一种器官。 氧气是大量分子的一部分,从最简单的分子到生物聚合物。 氧气在生命过程中的作用很大,因为氧气对营养物质(碳水化合物、蛋白质、脂肪)的氧化是生物体器官和组织运作所必需的能量来源。 身体中的大多数氧化还原反应都是在氧气及其活性形式的参与下进行的。 身体的吞噬(保护)功能也与氧气的存在有关,体内氧气含量的降低会降低其保护性能。 在吞噬细胞(能够捕获和消化异物的细胞)中,氧气O 02 被还原为超氧化物。 在医疗实践中,氧气用于在伴有缺氧(缺氧)、呼吸道疾病、心血管系统疾病、一氧化碳 (II) CO、氢氰酸 HCN 中毒以及呼吸功能受损的疾病的情况下吸入氧气. 临床实践中广泛使用的是高压氧合——在高压下使用氧气。 氧的同素异形体-臭氧O3作为一种极强的氧化剂,用于场所消毒、空气消毒和饮用水净化。 根据人体中的含量(0,16%),硫属于常量营养素。 就像氧气一样,它至关重要。 成年人每天对硫的需求量约为 4-5 克。硫是许多生物分子的一部分——蛋白质、氨基酸(胱氨酸、半胱氨酸、蛋氨酸等)、激素(胰岛素)、维生素(维生素 B1)。 头发、骨骼、神经组织的胡萝卜素中含有大量硫。 在生物体内,作为氨基酸一部分的硫被氧化。 该工艺的最终产物主要是硫酸盐。 此外,还会形成硫代硫酸盐、水泥硫磺和连多硫酸。 根据正文中的内容(10 - 5-10 - 7%) 硒是一种微量元素。 一些研究人员认为它是一个至关重要的元素。 硒来自食物 - 每年 55-110 毫克。 硒主要集中在肝脏和肾脏。 血液中硒的浓度为0,001-0,004 mmol / l。 毫无疑问,硒与生物体内的硫有关。 在高剂量下,硒主要积聚在指甲和头发中,它们基于含硫氨基酸。 硒保护身体免受汞 Hg 和镉 Cd 中毒的能力也是众所周知的。 硒促进这些有毒金属与其他活性中心的结合,以及那些不受其毒性作用影响的活性中心。 一个有趣的事实是饮食中硒含量高与癌症死亡率低之间的关系。 硒在高剂量时有毒。 动物体内硒化合物的分解导致释放出剧毒的二甲基硒,具有大蒜气味。 52.第VIIA组p元素的生物学作用。 它们的化合物在医学中的用途(氟和氯) 根据在人体中的含量,氯(0,15%)属于常量元素,而这一组的其余元素为微量元素(含量-105 %)。 各种化合物形式的卤素是人类和动物组织的一部分。 氯和碘是不可替代的元素,其余的则是组织的永久成分。 人体内氟的质量约为 7 毫克(~105 %)。 氟化合物集中在骨组织、指甲、牙齿中。 牙齿的成分包括约 0,01% 的氟,大部分落在牙釉质上,这与牙釉质中存在微溶性氟磷灰石有关。 体内缺乏氟化物会导致龋齿。 对氟的生物作用的兴趣主要与牙齿疾病的问题有关,因为氟可以保护牙齿免于龋齿。 牙组织(牙本质)的矿物基础是羟基磷灰石、氯磷灰石和氟磷灰石。 很多时候,不是覆盖着一层牙釉质的牙齿外表面受到破坏,而是牙本质的内部部分在牙釉质受损时暴露出来。 有人认为,虽然牙釉质受到轻微损伤,但氟化钠的引入促进了氟磷灰石的形成,促进了已经开始的损伤的再矿化。 氟化钠 NaF 在医疗实践中用作局部外用剂。 NaF的使用是基于氟磷灰石的形成。 同时,口腔环境也发生碱化,有助于中和细菌产生的酸。 氟不仅缺乏,而且过量也是有害的。 当饮用水中的氟含量超过最大允许值(1,2 毫克/升)时,牙釉质会变脆,容易被破坏,并出现慢性氟中毒的其他症状——骨脆性增加、骨骼畸形和全身疲惫. 在这种情况下发生的疾病称为氟中毒(fluorosis)。 人体含有约 100 克(2790 毫摩尔)氯。 氯离子起着重要的生物学作用。 它们激活一些酶,为胃液中的蛋白水解酶的作用创造有利环境,提供穿过细胞膜的离子通量,并参与维持渗透平衡。 氯离子具有穿透细胞膜的最佳半径。 这解释了它与 Na 和 K 离子共同参与产生一定的渗透压和调节水盐代谢。 氯化钠的每日需求量为 5-10 克。如前所述,氯化钠是胃中产生盐酸所必需的。 除了盐酸在消化过程中的重要作用外,它还能破坏各种致病菌(霍乱、伤寒)。 如果细菌随着大量的水进入胃部,那么由于 HCl 的稀释,它没有抗菌作用,细菌得以存活。 这会导致身体生病。 因此,在流行病期间,原水尤其危险。 胃内盐酸量不足,pH值升高,影响正常消化,严重影响人体健康。 随着胃液酸度的降低,在医疗实践中使用稀盐酸溶液。 随着胃部炎症(胃炎),消化性溃疡,胃液分泌增加,其酸度增加。 53.第VIIA组p元素的生物学作用。 它们的化合物在医学中的用途(溴、碘) 人体内溴的质量约为7毫克。 它主要位于内分泌腺中,主要位于垂体中。 溴化合物在身体正常功能中的生物学作用尚未得到充分阐明。 溴化合物抑制甲状腺的功能并增加肾上腺皮质的活动。 当溴化物被引入体内时,中枢神经系统最为敏感。 溴化物均匀地积聚在大脑的各个部位,并随着兴奋性的增加而平静地行动。 它们有助于恢复兴奋和抑制过程之间的紊乱平衡。 溴化物很容易被胃肠道吸收。 溴化物的毒性很低。 由于从体内排泄缓慢(在 30-60 天内),它们会积聚(累积),从而导致慢性中毒的发展,称为溴中毒。 如果出现慢性溴中毒迹象,应立即停用溴化物制剂。 此外,给予大量氯化钠(每天最多 25 克)以增加溴化物的释放率(勒夏特列原理),并开出大量饮料。 由于个体敏感性不同,溴制剂的用量从0,05克到2,0克不等。 碘是必需的生物元素之一,其化合物在代谢过程中起着重要作用。 碘影响某些蛋白质、脂肪、激素的合成。 人体约含碘25毫克。 在体内的碘总量中,一半以上存在于甲状腺中。 该腺体中几乎所有的碘都处于结合状态(以激素的形式),只有约 1% 以碘二酮的形式存在。 与血浆中的含量相比,甲状腺能够浓缩 I-25 倍。 甲状腺分泌激素甲状腺素和三碘甲腺原氨酸。 甲状腺功能低下(甲状腺功能减退)可能与其积累碘离子的能力下降以及饮食中缺乏碘(地方性甲状腺肿)有关。 对于地方性甲状腺肿,规定碘制剂:(碘化钾 KI 或碘化钠 NaI),剂量对应于人类每日对碘的需求(0,001 克碘化钾)。 在碘缺乏的地区,在食盐中添加 NaI 或 K 以预防地方性甲状腺肿! (每 1 公斤 2,5-100 克)。 随着甲状腺活动的增加(甲状腺功能亢进),由于甲状腺激素的过度合成,观察到代谢过程的速率异常增加。 由于这些药物对治疗甲状腺功能亢进症无效,因此使用了放射性碘 131 I 制剂,其辐射会破坏甲状腺的卵泡,从而减少激素的过量合成。 第VIIA族的所有元素都具有生理活性,而氯和碘对于生物体的生命活动是必不可少的。 氟被认为是生物体正常运作所必需的元素。 在体内,卤素是可以互换的,同时观察到协同作用和拮抗作用。 54.气溶胶 气溶胶是具有气态分散介质的分散系统。 根据分散相的聚集状态,可以区分雾 - 具有液体分散相的气溶胶; 烟雾、灰尘 - 具有固体分散相的气溶胶; 烟雾 - 具有混合分散相的气溶胶。 根据分散系统的分类,气溶胶分散相的粒径范围为 107 到109 米 与其他分散系统一样,气溶胶通过两种方法获得:冷凝和分散。 冷凝法 分散相是通过分子凝聚成胶体大小颗粒的物理过程从气相获得的。 分散方法 胶体大小的颗粒是通过研磨较大的聚集体获得的。 气溶胶具有散射光的能力。 气溶胶的分散相颗粒不具有双电层,但分散相颗粒通常带有电荷。 电荷是由于摩擦或由于气体离子的吸附而产生的。 应该注意的是,气溶胶颗粒(小的和大的)经常带有相反符号的电荷。 大量气溶胶沿高度按尺寸分离颗粒会导致出现高强度电场。 因此,云中发生放电 - 闪电。 气溶胶是动力学和聚集不稳定的系统,因为在相界没有双电层。 因此,气溶胶的凝结速度比溶胶快。 在医学上,气雾剂用于吸入疗法,起到保护受损皮肤、消毒的作用。 有时气溶胶的形成是非常不希望的。 在铸造、陶瓷行业以及各种矿物(矿石、煤、石棉等)的提取和加工过程中,会形成对人体健康有害的气溶胶。 含有煤颗粒的气溶胶会导致肺部疾病 - 炭疽病、氧化硅 (IV) - 矽肺、石棉 - 石棉肺。 过敏性疾病是由植物花粉、棉花、亚麻、大麻等加工过程中产生的粉尘形成的气溶胶引起的。细菌、霉菌和病毒的悬浮物——微生物或细菌气溶胶——是传播传染病的途径之一:肺结核、流感、急性呼吸道疾病。 燃料燃烧过程中形成的气溶胶对人体有害,其分散相由煤烟、焦油、灰烬和致癌碳氢化合物组成。 烟雾对健康尤其有害。 因此,对抗灰尘和大气污染变得越来越重要。 通过引入非废物技术实现从气溶胶中净化空气——使用过滤器、旋风分离器(离心除尘器)和高压电场捕获分散相的颗粒。 55. 乳液 乳液是微多相体系,其中分散相和分散介质是不混溶的液体。 分散相(液滴)的粒径范围为 104 至 106 m。 根据分散相的浓度,乳液分为:稀释的、浓缩的和高度浓缩的。 根据分散相和分散介质的性质,有: 1) 非极性液体 (DF) 在极性液体 (DS) 中的乳液 - 直接乳液,称为第一类乳液或“油/水”型 (O / W) 乳液; 2) 极性液体 (DF) 在非极性液体 (DS) 中的乳液 - 反相乳液,称为第二类乳液或“水/油”型 (W/O) 乳液。 这里,DF和DS分别是分散相和分散介质,“水”是任何极性液体,“油”是非极性液体。 乳液类型可设置: 1)电导率测量; 2) 与过量的极性或非极性液体混合; 3)用水溶性或油溶性染料染色; 4)通过在疏水或亲水表面上润湿和铺展乳液滴。 乳液与其他分散体系一样,可以 通过缩合和分散法获得。 作为粗分散体的乳液是动力学和聚集不稳定的体系。 当分散相的液滴碰撞时,它们会合并(聚结)。 由于聚结,乳液分离成两个连续的液相。 乳化剂用于增加乳液的稳定性。 这些是表面活性剂,由于在相界处吸附,它们会降低界面张力值并形成机械强度高的吸附膜。 如果乳化剂是离子型表面活性剂,则它赋予分散相的液滴相同符号的电荷,液滴相互排斥。 形成的乳液类型取决于乳化剂的性质。 分散介质总是最能溶解或润湿乳化剂的液体。 高级脂肪酸的盐、高级脂肪酸和多元醇的酯、长链胺用作乳化剂。 乳液广泛存在于自然界中。 乳液是牛奶、奶油、酸奶油、黄油、蛋黄、乳状植物汁、原油。 含有药用物质的乳剂在医学上应用广泛:第一种(O/W)内服,第二种(W/M)外用。 众所周知,植物和动物脂肪以乳化形式(牛奶)更容易被人体吸收。 在这种情况下,胆酸和脱氧胆酸的衍生物充当乳化剂。 有时需要打破产生的乳液。 破乳称为破乳。 通过升高和降低温度,暴露于电场,离心,添加电解质和特殊物质 - 破乳剂来进行破乳。 反乳化剂是比乳化剂具有更大表面活性的表面活性剂,但不具有形成机械强吸附层的能力。 56. 胶体表面活性剂 胶体表面活性剂是在相同溶剂下,根据条件形成真正的胶体溶液的物质。 如前所述,表面活性剂分子是两亲性的。 它们由非极性和极性基团组成。 非极性基团,例如烃链,对极性溶剂 - 水没有亲和力,对极性基团来说亲和力很高。 非极性基团之间存在疏水(范德华力)相互作用。 链长约为 1022 碳原子由于烃自由基的疏水相互作用和极性基团与水的强相互作用,使表面活性剂分子缔合形成胶束。 胶体表面活性剂的最低浓度,从其溶液中形成胶束开始,称为临界胶束浓度(CMC)。 所得胶束的形状取决于溶液的浓度。 在低浓度的胶体表面活性剂下,会形成球形胶束。 胶体表面活性剂溶液浓度的增加首先导致其数量的增加,然后导致形状的变化。 在较高浓度下,会形成圆柱形和层状胶束,而不是球形胶束。 CMC 值取决于多种因素:胶体表面活性剂的性质、温度以及是否存在杂质杂质,尤其是电解质。 CMC 可以通过溶液的性质来确定,这取决于动力学活性颗粒的数量和大小,特别是通过渗透压、表面张力、电导率和光学特性的变化。 由于动力学活性粒子(离子、分子、胶束)的大小及其数量在“真溶液-胶体溶液”转变过程中发生变化,因此在“性质-浓度”图上出现了对应于CMC的断点。 胶体表面活性剂溶液最重要的特性之一是增溶作用,因此它们被广泛用于国民经济的各个部门和医药领域。 增溶的机理在于非极性物质溶解在胶束的疏水核中。 增溶现象广泛应用于国民经济的各个部门:食品工业、制药工业(获得药用物质的液体形式)。 在“水-磷脂”体系中,摇动搅拌形成球形胶束-脂质体。 磷脂分子在脂质体中形成双层膜,其中极性基团面对水,非极性基团彼此面对。 脂质体可以被认为是生物膜的模型。 它们可用于研究膜的渗透性以及各种因素对各种化合物的影响。 脂质体广泛用于将药物靶向递送至某些器官或受影响区域。 脂质体可以将药物转运到细胞中。 脂质体膜用于免疫学研究以研究抗体和抗原之间的相互作用。 作者:Drozdova M.V.、Drozdov
▪ 组织学。 婴儿床
用于触摸仿真的人造革
15.04.2024 Petgugu全球猫砂
15.04.2024 体贴男人的魅力
14.04.2024
▪ 文章 木星、土星和海王星在哪些方面不完全符合行星的经典定义? 详细解答 ▪ 文章 业余无线电爱好者。 收音机。 无线电电子电气工程百科全书 ▪ 文章方案,爱立信 8xx、T1x、A1018 手机电缆的引脚排列(引脚排列)。 无线电电子电气工程百科全书
www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 查看其他文章 部分
查看其他文章 部分 